Исследование концентрационной функции почек. Концентрационная способность почки
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://allbest.ru/
Министерство здравоохранения Республики Беларусь
УО « Гродненский государственный медицинский университет»
на тему «Функциональные тесты в оценке концентрационной функции почек.»
Гродно 2012
Введение
Почки являются основным органом поддержания гомеостаза в организме, что обеспечивается следующими функциями:
Обеспечение постоянства кислотно-основного, электролитного состава крови;
Поддержание объема крови и других жидкостей внутренней среды;
Экскреция конечных продуктов обмена и чужеродных веществ;
Секреция физиологически активных веществ (ренина, простагландинов, эритропоэтина, активных форм витамина Д).
Осуществление каждой из функций обеспечивается несколькими процессами, лежащими в основе деятельности почки: гломерулярной фильтрацией, канальцевой реабсорбцией и секрецией, синтезом новых веществ в структурах почки.
В механизме образования мочи и сохранения осмотического гомеостаза в организме важную роль играют осмотическое концентрирование и осмотическое разведение мочи.
Осмотическое концентрирование - образование мочи с большей концентрацией осмотически активных веществ, чем в плазме крови. Осмотическое разведение мочи - выделение мочи с меньшей концентрацией осмотически активных веществ, чем в плазме крови.
Показателями осмотической концентрации являются осмолярность и осмоляльность. Осмолярность (мОсм/л) - концентрация осмотически активных веществ в 1 литре раствора. Осмоляльность (мОсм/кг Н2О) - концентрация осмотически активных веществ в 1 кг воды (т.е. растворителя).
Факторы, определяющие осмоляльность плазмы - концентрация натрия, глюкозы, азотистые продукты (в основном мочевина), а также отсутствующие в норме (так называемые неизмеряемые) осмоли - спирты, маннитол. Осмоляльность плазмы - один из наиболее строго поддерживаемых физико-химических параметров, имеющий коэффициент вариации 1,67% (для сравнения: коэффициент вариации для калия составляет 6,6%) [Ю. В. Наточин, 1993]. В норме осмоляльность плазмы составляет 280-295 мОсм/кг Н2О.
Осмоляльность мочи определяется в основном электролитами и мочевиной, составляет 300-800 мОсм/кг Н2О. Но в зависимости от величин приема жидкости и экстраренальных потерь может колебаться в более широком диапазоне - от 200 до 1200 мОсм/кг Н2О.
В процессе осмотического концентрирования мочи в почке принимают участие все отделы канальцев, интерстициальная ткань, сосуды мозгового вещества .
Механизмы осмотического концентрирования мочи:
* Проксимальный каналец: реабсорбция воды и осмотически активных веществ (главным образом натрия и мочевины) происходит в таких соотношениях, что осмоляльность канальцевой жидкости остается равной осмоляльности ультрафильтрата плазмы (280-295 мОсм/кг Н2О).
* Нисходящий отдел петли Генле (стенка проницаема для воды, непроницаема для осмотически активных веществ): продолжается реабсорбция воды в интерстиций по осмотическому градиенту. По мере продвижения от коркового слоя по мозговому веществу почки до вершин пирамид количество канальцевой жидкости постепенно уменьшается, а ее осмоляльность возрастает, достигая 1200-1500 мОсм/кг Н2О в месте поворота нисходящего отдела петли Генле в восходящий отдел.
* Тонкий восходящий отдел петли Генле (проницаем для воды): в этом отделе концентрация осмотически активных веществ в канальцевой жидкости выше, чем в интерстиции, поэтому вода по осмотическому градиенту из интерстициальной ткани поступает в просвет этого отдела.
* Толстый восходящий отдел петли Генле (стенка непроницаема для воды, но проницаема для натрия, хлора): при движении жидкости по этому отделу идет активная реабсорбция натрия и хлора, а вода остается в просвете канальцев, и в начальные отделы дистального извитого канальца всегда поступает гипотоничная жидкость (менее 200 мОсм/кг Н2О).
* Дистальные канальцы, собирательные трубки: продолжающийся процесс реабсорбции воды, осмотически активных веществ (натрия, мочевины) регулируется антидиуретическим гормоном (АДГ).
АДГ увеличивает проницаемость стенки дистальных канальцев и собирательных трубок для воды, усиливает реабсорбцию натрия и хлора в клетках восходящего толстого отдела петли Генле, повышает проницаемость стенок собирательных трубок для мочевины в мозговом слое почки. Таким образом, под действием АДГ увеличивается реабсорбция воды из просвета канальцев в интерстициальную ткань почек. В результате выделяется мало мочи с высоким содержанием в ней осмотически активных веществ (до 1200 мОсм/кг Н2О). При дефиците АДГ проницаемость стенок дистального сегмента нефрона и собирательных трубок для воды снижается, натрий продолжает реабсорбироваться в интерстициальную ткань, снижается накопление мочевины в мозговом веществе почки. Это приводит к уменьшению реабсорбции воды, выделению большого количества гипоосмолярной мочи (около 400 мОсм/кг Н2О).
Поддержание водного баланса в организме обеспечивается регуляторной системой, включающей волюморецепторы, осморецепторы, натриорецепторы, нервные и гуморальные центры. При обезвоживании организма увеличивается концентрация осмотически активных веществ в плазме крови, возбуждаются осморецепторы, усиливается секреция АДГ, возрастает всасывание воды в канальцах. Активация волюморецепторов (при увеличении в организме воды и солей натрия) ведет к снижению секреции АДГ, активации натрийуретического гормона, уменьшению секреции ренина, ангиотензина, альдостерона. Это ведет к снижению реабсорбции натрия, увеличению диуреза. В конечном итоге происходит восстановление объема крови и внеклеточной жидкости.
Оценка концентрационной функции
почка гомеостаз осмотический моча
Для оценки концентрационной функции почек используют ряд методов:
1. Определение относительной плотности и осмоляльности мочи.
Относительная плотность определяется количеством растворенных веществ в моче. На относительную плотность мочи влияют характер пищи, количество выпитой жидкости, выраженность экстраренальных потерь, характер растворенных в моче частиц (белок, сахар). В норме в обычных условиях относительная плотность составляет 1008-1025 г/л.
Осмоляльность мочи является более строгим показателем, в меньшей степени зависящим от характера растворенных частиц. Осмоляльность и относительная плотность тесно связаны между собой (табл. 1). Использование единиц осмоляльности дает возможность сравнения мочи и крови.
2. Проба Зимницкого - это один из наиболее простых и доступных методов изучения функции почек. С помощью пробы Зимницкого врач определяет такие функции почек как способность концентрировать и выделять мочу. Проба Зимницкого также дает представление о работе сердца.
Что определяет проба Зимницкого?
Анализ мочи по Зимницкому позволяет врачу определить способность почек концентрировать мочу. Концентрационная способность почек представляет собой естественный регуляционный механизм, который позволяет организму сохранять постоянство жидкой среды. Так, например, при увеличении количества жидкости в организме (обильное питье, жидкая пища) почки выделяют большее количество мочи разбавленной мочи. Напротив, если, организм человека получает мало воды, почки начинают вырабатывать очень концентрированную мочу и таким образом экономят жидкость.
Анализ мочи по Зимницкому определяет плотность мочи - это показатель, который выражает количество растворенных в моче продуктов обмена веществ (соли, белки, аммиак и пр.). Плотность мочи зависит от количества употребляемой жидкости, а также от концентрационной способности почек. В норме плотность мочи колеблется от 1,003 до 1,035. В течение суток человек потребляет неодинаковое количество жидкости, поэтому плотность мочи в разное время дня меняется: днем моча менее плотная вследствие потребления жидкости, утренняя моча, напротив, обладает наибольшей плотностью.
С помощью пробы Зимницкого определяется также суточный диурез - общее количество мочи, выделенное в течение суток. В норме в течение суток выделяется около 1,5-2 л мочи. С помощью пробы Зимницкого определяют, какое количество мочи выделилось днем, а какое ночью. Суточные колебания диуреза (разное количество мочи, выделяемой в течение дня и в течение ночи) позволяют выявить некоторые отклонения в работе почек или сердца.
Как проводится сбор мочи для пробы Зимницкого?
Сбор мочи для пробы Зимницкого проводится в течение одних суток. Во время сбора мочи обследуемый должен питаться как обычно и принимать обычное для себя количество жидкости (желательно, не более 1,5-2 л жидкости в сутки). Параллельно со сбором мочи необходимо посчитать количество принимаемой жидкости (включая жидкую пищу), так как это имеет значение в расчете результатов анализа.
Обследуемому выдают 8 баночек, в каждую из которых по истечении суток должна быть собрана моча. В 6 часов утра первого дня обследуемый опорожняет мочевой пузырь в унитаз. Затем, точно каждые 3 часа следует собирать всю мочу в соответствующую баночку. Таким образом, мочу собирают в 9, 12, 15, 18, 21, 24, 3, и 6 часов утра следующих суток. Всего получается 8 порций мочи, по одной порции мочи в каждой баночке.
Все баночки с мочой, а также данные о том, сколько жидкости было выпито в течение суток, направляют в лабораторию. До отправки анализов мочи в лабораторию их рекомендуется держать в холодильнике.
Каковы нормы пробы Зимницкого?
С помощью пробы Зимницкого оценивается несколько параметров функции почек: плотность мочи, колебания плотности мочи в течение суток, количество жидкости, выделенное в течение суток, колебания количества жидкости выделенного днем и ночью. При нормальной функции почек результаты пробы Зимницкого следующие:
Количество мочи, выделенной в течение суток (суточный диурез) - 1500 - 2000мл
Отношение количества жидкости, выделенной почками, к количеству жидкости выпитой в течение суток 65 - 80%.
Количество мочи, выделенной днем, значительно превышает количество мочи, выделенной ночью (днем 2/3 от общего количества мочи, ночью 1/3)
Плотность мочи в одной или нескольких порциях не менее 1,020
Значительные колебания количества и плотности мочи в разных порциях в течение суток. Например, в течение дня одна порция составляет 300мл, а ночью порция - 50мл. Или, в одной порции мочи плотность 1,008, а в другой порции - 1,022.
Интерпретация (расшифровка) результатов пробы Зимницкого.
При проведении пробы Зимницкого у людей с нарушенной функцией почек наблюдаются различные отклонения от нормы. Основные нарушения, выявляемые с помощью пробы Зимницкого следующие:
Низкая плотность мочи - это результат пробы Зимницкого, при котором ни в одной из порций плотность мочи не превышает 1,012-1,013. Низкая плотность мочи называется гипостенурией и указывает на нарушение концентрационной способности почек.
Нарушение концентрации мочи встречается во время приема мочегонных лекарств (фуросемид, этакриновая кислота и др.), а также при следующих заболеваниях:
Поздние стадии хронической почечной недостаточности встречаются у людей, длительно страдающих некоторыми заболеваниями почек (гломерулонефрит, пиелонефрит, амилоидоз почек и др.) При хронической почечной недостаточности наблюдаются следующие основные симптомы: ухудшение общего состояния, головные боли, вялость, снижение аппетита, жажда, неприятный запах изо рта. В биохимическом анализе крови отмечается повышение уровня креатинина, мочевины и др.
Обострение двустороннего пиелонефрита, или воспаление лоханок обеих почек также является причиной снижения плотности мочи. При пиелонефрите основными симптомами являются: периодические боли в поясничной области, повышение температуры тела до высоких цифр, головные боли, тошнота и др.
Тяжелая сердечная недостаточность в некоторых случаях приводит к повреждению почек и нарушению процесса концентрации мочи. При плохой функции сердца кровь застаивается в почках и в других органах, что приводит к нарушению их работы. При сердечной недостаточности отмечается выраженная одышка, слабость, головные боли, отеки на ногах, возможна водянка (асцит).
Несахарный диабет - это заболевание, при котором из-за недостатка особого гормона (вазопрессина) почки не способны возвращать жидкость из мочи. Организм теряет много жидкости с мочой. Симптомами несахарного диабета являются: выраженная жажда, учащенное мочеиспускание, снижение массы тела, сухая кожа, выделение большого количества мочи в сутки (до 5-10 литров) и др.
Низкая плотность мочи, которая практически не изменяется в зависимости от времени суток или количества принятой жидкости называется гипоизостенурия. При гипоизостенурии плотность мочи в каждой порции пробы Зимницкого, как правило, не превышает 1,009 и практически не изменяется на протяжении суток. Такой результат пробы Зимницкого говорит о том, что почки не в состоянии приспосабливаться к меняющимся условиям поступления жидкости в организм и указывает на тяжелую почечную недостаточность.
Повышение плотности мочи, как правило, указывает на проникновение в мочу большого количества плотного вещества (например, белка, глюкозы и др.) Заболевания, при которых плотность мочи повышена следующие:
Сахарный диабет является причиной выделения большого количества глюкозы с мочой. Наличие глюкозы в моче повышает ее плотность. Как правило, при наличии глюкозы в моче (глюкозурия) отмечается учащенное мочеиспускание, жажда, снижение массы тела, увеличение аппетита и другие симптомы сахарного диабета.
Острый или хронический гломерулонефрит - это заболевание, при котором нарушается проницаемость клубочков почек и в мочу попадают крупные вещества крови: клетки крови, белки. Наличие белка в моче называется протеинурией. Белок является причиной повышения плотности мочи. Кроме того, при гломерулонефрите может наблюдаться гематурия (наличие крови в моче, см. Анализ мочи по Нечипоренко), боли в поясничной области, повышение температуры тела и т.д.
Токсикоз беременных в некоторых случаях способствует повышению плотности мочи вследствие выделения с мочой белка.
Как уже упоминалось выше, в норме человек выделяет от 65 до 80% жидкости, употребленной в течение дня. Если в течение дня обследуемый с сердечной недостаточностью и отеками выделил менее 65% от принятой жидкости, это говорит о том, что заболевание усугубляется и отек нарастает. Если же выделение мочи составляет более 80% от количества принятой жидкости - состояние улучшается, отек спадает.
Увеличение количества мочи, выделяемой в течение суток, более 2000мл называется полиурией и наблюдается при следующих состояниях:
Сахарный диабет - является причиной выделения глюкозы с мочой, что притягивает в мочу жидкость. При сахарном диабете количество мочи, выделяемой в течение суток, повышено.
Несахарный диабет - это недостаточность гормона, способствующего задержке воды в организме (вазопрессин). Отсутствие этого гормона является причиной больших потерь воды с мочой.
Почечная недостаточность встречается у людей, страдающих заболеваниями почек. При почечной недостаточности почки не способны концентрировать мочу, что приводит к повышенному выделению жидкости с мочой.
Проба Рейзельмана - модификация пробы Зимницкого, согласно которой сбор мочи проводят через свободные интервалы времени. Используется в детском возрасте.
При сохраненной способности почек к осмотическому разведению и концентрированию мочи отмечаются:
Значительные колебания объема мочи в отдельных порциях (50-250 мл);
Максимальная относительная плотность, характеризующая способность почек концентрировать мочу, должна быть не ниже 1025 г/л;
Минимальная относительная плотность, отражающая способность почек к осмотическому разведению мочи, у здорового человека должна быть ниже осмотической концентрации (осмоляльности) безбелковой плазмы, равной 1010-1012, и обычно составляет 1003-1006;
Значительные колебания относительной плотности мочи: разница между максимальными и минимальными показателями должна составлять не менее 12-16 ед. (например от 1006 до 1020 или от 1010 до 1026 и т. д.); значительные суточные колебания относительной плотности мочи связаны с сохраненной способностью почек то концентрировать, то разводить мочу в зависимости от постоянно меняющихся потребностей организма;
Отчетливое (примерно двукратное) преобладание дневного диуреза над ночным.
3. Нагрузочные тесты. Проба на концентрирование.
Исследуемый находится в режиме сухоедения в течение 12-24 часов. Из рациона исключаются вода, фрукты, ягоды, овощи, включаются рассыпчатые каши, сухари, крутое яйцо, творог, мясо. Исследование начинается в 15.00, опорожняют мочевой пузырь, после чего моча собирается каждые 3 часа, определяется количество мочи, относительная плотность или осмоляльность. Время окончания пробы определяется по мере получения результатов (достижение уровня удельной плотности 1025 г/л и выше), а также с учетом самочувствия пациента.
* дети раннего возраста
* заболевания центральной нервной системы
* активность воспалительного процесса в почках
* почечная недостаточность
* обменные нефропатии (в т.ч. нервно-артритический диатез).
В основе нарушения концентрационной способности почек лежит снижение осмотического давления в ткани мозгового слоя почек. Это может быть обусловлено как поражением самих почек, так и экстраренальными факторами (табл. 2) .
При прогрессировании заболеваний почек снижение концентрационной способности сочетается с нарушением способности почек к разведению.
4. Нагрузочные тесты. Проба с водной нагрузкой.
Во время исследования не дается пища, пациент находится на полупостельном режиме. Используют кипяченую воду комнатной температуры 20 мл/кг, которая выпивается в течение 15-30 минут. Затем опорожняется мочевой пузырь, и мочу собирают каждые 30 минут в течение двух часов (4 порции) и еще в течение 1-2 часов через час (1-2 порции). Для получения продолженного максимального диуреза в начале каждого очередного сбора мочи ребенку дают выпить количество воды, равное объему полученной мочи за предыдущий период плюс количество воды на экстраренальные потери.
Противопоказания к проведению пробы:
* отечный синдром
* гипертензионный синдром
* сердечная недостаточность
* состояния, сопровождающиеся тахикардией.
Интерпретация результатов:
Здоровый ребенок за первые два часа выделяет не менее 70% выпитой жидкости, относительная плотность мочи при этом снижается (до 1001-1005 г/л);
При снижении способности почек к разведению мочи значения относительной плотности не достигают этих показателей (обычно 1004- 1009 г/л);
При полном выпадении функции разведения относительная плотность находится на уровне 1010-1012 г/л, т. е. соответствует осмотической концентрации плазмы (изостенурия).
Олигурия, обусловленная нарушением функции почек, в большинстве случаев сочетается со снижением осмоляльности мочи (или удельной плотности). Олигурия у пациентов с сохраненной функцией почек сопровождается отделением мочи с нормальной или повышенной удельной плотностью.
Нагрузочные пробы позволяют оценить функциональное состояние почек и их резервные возможности, но наличие ряда противопоказаний (в т.ч. ранний детский возраст) ограничивает их применение.
В настоящее время для оценки концентрационной функции почек используется десмопрессин (синтетический аналог природного антидиуретического гормона аргинин-вазопрессина). По сравнению с естественным гормоном, десмопрессин обладает более мощным и прологированным действием и не оказывает выраженного сосудосуживающего эффекта.
Одной из лекарственных форм десмопрессина является препарат Пресайнекс - спрей назальный дозированный. Согласно результатам зарубежных многоцентровых исследований препарат отличается высокой точностью дозировки, удобной формой выпуска, безопасным и эффективным способом применения, не вызывает атрофию слизистой оболочки носа.
Дозы Пресайнекса для проведения теста на концентрационную способность почек зависят от возраста:
Средняя доза
Взрослые - 40 мкг/сут
Дети до года - 10 мкг/сут
Дети старше года - 10-20 мкг/сут
Проведение теста на концентрационную способность почек с использованием Пресайнекса предусматривает последовательное выполнение следующих условий:
* Опорожнить мочевой пузырь (первую порцию выливают). Повторный забор мочи осуществить через 4 часа после первого опорожнения мочевого пузыря.
* Еще один забор мочи -- через 4 часа.
* Для определения осмоляльности собирается всего две порции мочи в течение 8 часов.
* Во время исследования ограничить количество принимаемой жидкости (объем жидкости, поступившей за 1 час до исследования и в течение 8 часов после, не должен превышать 0,5 литра).
Полученные результаты оценивают по показателям осмоляльности.
* Норма осмоляльности для взрослых -- до 1200 мОсм/кг Н2О.
* У детей норма осмоляльности - 600 мОсм/кг Н2О (должна достигать в течение 5 часов после введения препарата).
* Если выявленный показатель осмоляльности ниже указанных значений, то тест необходимо повторить. Повторное выявление низкого показателя свидетельствует о нарушении концентрационной способности почек. В этом случае пациент нуждается в дополнительном углубленном обследовании.
Таким образом, применение Пресайнекса является новым неинвазивным методом диагностики нарушений концентрационной функции почек, в том числе у детей раннего возраста.
Литература
1. Материалы российской научно-практической конференции «Актуальные проблемы нефрологии детского возраста». - Оренбург, 21 - 23 мая 2010 г. - Оренбург, 2010.
2. Наточин Ю. В. Введение в нефрологию / Ю. В. Наточин, Н. А. Мухин. - ООО Аргумент, ГЭОТАР-МЕДИА, ИЗДАТЕЛЬСКАЯ ГРУППА, 2007 г. - 160 с.
3. Нефрология в терапевтической практике / Под ред. А. С. Чижа. - Минск: Высшая школа, 1998. - 557 с.
4. Папаян А. В. Клиническая нефрология Руководство для врачей / А. В. Папаян, Н. Д. Савенкова. - СПб.: СОТИС, 1997. - 720 с.
5. Соматические болезни Руководство
Размещено на Allbest.ru
Подобные документы
Морфо-функциональная характеристика мочевыделительной системы. Анатомия почек. Строение почек. Механизм мочеобразования. Кровоснабжение почек. Нарушение функций мочевыделительной системы при патологии, пиелонефрит. Методы исследования мочи и работы почек.
реферат , добавлен 31.10.2008
Этиология и патогенез нарушения функций почек: клубочковая и канальцевая фильтрация, реабсорбция, секреция, концентрация и разведение мочи. Клиническая диагностика заболеваний почек, лабораторное исследование и анализ физических и химических свойств мочи.
курсовая работа , добавлен 15.06.2015
Особенности патологии почек. Общие причины нарушения функций почек. Проявление расстройств мочеобразования и мочевыведения. Проявления расстройств почек. Механизмы нарушения экскреторной функции почек. Основные виды патологии почек по происхождению.
презентация , добавлен 05.03.2017
Механизмы образования мочи. Ренальные и экстраренальные пути экскреции веществ. Основные функции почек. Кровоток в разных частях почек. Строение кровеносной системы. Классификация нефронов. Механизмы мочеобразования. Фильтрация, реабсорбция, секреция.
презентация , добавлен 12.01.2014
Изучение жалоб нефрологических больных, сбора анамнеза у пациента с подозрением на заболевание почек. Обзор причин обострения, характера течения болезни, пальпации. Анализ количественных методов изучения осадка мочи, синдрома почечной недостаточности.
презентация , добавлен 25.12.2011
Строение органов мочевыделительной системы человека: мочевого пузыря, мочеточников, лоханки, почечных чашек, мочеиспускательного канала. Этапы обмена веществ в организме. Рассмотрение функций почек: выделительной, защитной и поддержания гомеостаза.
презентация , добавлен 15.04.2013
Рассмотрение синдрома нарушения функций почек, приводящего к расстройству водного, электролитного, азотистого и других видов обмена. Критерии RIFLE диагностики и классификации острого повреждения почек. Стандартизация определений нарушения функции почек.
презентация , добавлен 30.05.2014
Интероцептивная функция почек. Исследование влияния одной почки на другую. Роль почечной рецепции в развитии гипертонии. Денервированная почка. Роль блуждающих нервов в осуществлении рефлекторных реакций, направленных на сохранение ионного баланса.
реферат , добавлен 01.06.2010
Топография почек, их скелетотопия. Особенности топографической анатомии почек, почечных сосудов, мочеточников и мочевого пузыря в детском возрасте. Солитарные кисты почек. Последствия и причины развития гипоплазии. Патология удвоения почек, ее виды.
презентация , добавлен 07.09.2015
Основные функции почек. Правила сбора мочи для исследования. Цвет, запах, кислотность мочи, содержание в ней глюкозы, эритроцитов, лейкоцитов и белка. Функциональная и патологическая протеинурия. Проявления нефротического и азотемического синдромов.
ОЖИРЕНИЕ И МЕТАБОЛИЗМ 1"2009
Концентрационная функция почек при первичном гиперпаратиреозе
Первичный гиперпаратиреоз (пГПТ) - заболевание, имеющее множество клинических проявлений: остеопороз и повышенный риск переломов, образование конкрементов в почках, ухудшение функции почек, язвенная болезнь желудка и двенадцатиперстной кишки, мышечная слабость, утомляемость, - все они являются прямым следствием повышения уровня паратиреоидного гормона (ПТГ) и гипер-кальциемии. Одним из интересных аспектов этого заболевания являются полиурия и полидипсия. В настоящее время мало изучен патогенез этих явлений, и даже имеющиеся клинические описания их выраженности представляют собой лишь разрозненные данные, встречающиеся в некоторых публикациях. Целью настоящего обзора является обобщение имеющихся клинических данных и прояснение механизмов развития симптомов.
Полиурия часто сопровождает пГПТ, однако выраженная полиурия и обезвоживание организма встречаются достаточно редко, как правило, только при тяжелом течении заболевания, сопровождающимся высокими цифрами ПТГ и кальциемии. К тому же концентрационная функция почек почти всегда восстанавливается после проведения радикального оперативного лечения. Именно поэтому большинство клинических врачей относятся к полиурии при пГПТ несколько пренебрежительно. Однако в связи с тем, что пГПТ в настоящее время диагностируется все чаще и чаще, многие пациенты имеют мягкую форму заболевания, далеко не всем пациентам требуется оперативное лечение, а возможно консервативное ведение и наблюдение, внимание к нарушению концентрационной функции почек должно повыситься. В исследовании, посвященном предикторам смерти при пГПТ, нарушение концентрационной функции почек явилось одним из важных факторов, наряду с пожилым возрастом, мужским полом, сниженной клубочковой фильтрацией, наличием сердечно-сосудистых заболеваний, сахарного диабета и большим объемом удаленной опухоли. Повышение осмоляльности суточной мочи, измеренной с нагрузкой питрессином, минирином или в ходе пробы с сухоедением, на 1 мосмоль/л снижало риск смерти на 0,11% . Одновременно с этим риск смерти пациентов, перенесших пГПТ, в любом случае выше популяционного, даже при сохранной концентрационной функции почек .
По данным исследования G. Hedback и соавт., наиболее широко раскрывающего тему нарушения кон-
А.В. Беляева, Н.Г. Мокрышева, Л.Я. Рожинская
ФГУ Эндокринологический научный центр, Москва (директор - академик РАН и РАМН, проф. И.И. Дедов)
центрационной функции почек при пГПТ, осмоляль-ность мочи на фоне стимуляционных проб у пациентов с пГПТ составила 636+160 мосмоль/л . После проведения аденомэктомии в течение недели у 59 из 63 пациентов произошло значимое увеличение осмоляль-ности мочи на 143+114 мосмоль/л, в среднем на 28%. У остальных пациентов концентрационная функция почек не изменилась или слегка ухудшилась. Анализ долгосрочного эффекта (3-5 лет) аденомэктомии в том же исследовании показал, что за это время осмо-ляльность мочи сохраняла тенденцию к повышению, улучшение по сравнению с дооперационными показателями наступило у 33 из 35 пациентов на 202+132 мосмоль/л, то есть в среднем на 37%. Основным недостатком исследования является его ретроспектив-ность, отсутствие рандомизации при формировании выборки и отсутствие контрольной группы.
По мнению исследователей, основным достижением их работы стало доказательство того, что после оперативного лечения происходит восстановление концентрационной функции почек. Этот результат подтверждает данные двух аналогичных исследований, проведенных в 60-х годах прошлого века, более точными и статистически обработанными данными . Также в ходе анализа были получены свидетельства того, что степень увеличения осмоляльности мочи зависит от уровня кальциемии до операции, и, в меньшей степени, от возраста пациента, наличия сопутствующего поражения сердечно-сосудистой системы и выраженности суточной гиперкальциурии. Можно предположить, что исходная тяжесть заболевания напрямую влияет на концентрационную функцию почек. Тем не менее, у пациентов с мягкой формой заболевания, хотя их было немного включено в исследование, всего 14 человек, тоже происходило восстановление осмоляльности мочи после оперативного лечения и исходные показатели в целом не отличались от основной группы. Среди пациентов с не изменившейся или, против ожиданий, снизившейся осмоляль-ностью почти все имели мочекаменную болезнь и инфекцию мочевых путей, при этом у большинства пациентов с подобным поражением почек восстановление осмоляльности мочи произошло в полном объеме. Попытки связать степень восстановления осмо-ляльности мочи с уровнем креатинина крови, скоростью клубочковой фильтрации, поражением костей, нейромышечными симптомами не удались. У семи
пациентов, прослеженных в течение в среднем пяти лет без проведения оперативного лечения, произошло снижение осмоляльности мочи на 15±8%, но авторами не указана динамика основного заболевания и состояния почек у данных больных. В другом исследовании тех же авторов была выявлена слабая значимая корреляция осмоляльности мочи и объема удаленной опухоли, что косвенно свидетельствует о том, что нарушение концентрационной функции почек является отражением тяжести болезни . Интересно, что повышение риска смерти при ухудшении концентрационной функции почек не соответствовало небольшому снижению риска смерти у пациентов с мочекаменной болезнью, на основании чего авторы делают вывод, что механизм поражения почек, приводящий к снижению концентрационной функции при пГПТ и камне-образованию может быть различен .
Обратимость нарушения концентрационной функции почек показана и в другой работе . Авторы отметили у пациента с пГПТ гиперосмолярность плазмы, полиурию, изостенурию, а также потерю почками К+ и повышение уровня вазопрессина в сыворотке. После проведения аденомэктомии все показатели, кроме гиперкалиурии, нормализовались. В другом клиническом описании двух случаев гиперкальциеми-ческой нефропатии, ассоциированной с пГПТ, пациентам была проведена биопсия почек . Данные гистологического исследования выявили признаки хронических воспалительных изменений интерстиция почки и фокальной атрофии и некроза канальцев, а также фокальный склероз клубочков. Следует отметить, что описание клинической картины соответствует тяжелой форме пГПТ в обоих случаях.
В исследовании Jansson S. (в 2004 году), в котором проводилось обследование 20 пациентов, напротив, показано, что ни после инъекции бифосфонатов, ни после оперативного лечения пГПТ изменения осмоляльности мочи не произошло. Стоит отметить, что в данной работе осмоляльность мочи определялась без предварительной стимуляции, и перед проведением лечения проводилась регидратация тем пациентам, у кого была в этом необходимость . Аналогичный результат получен в исследовании van"t Hoff W. and Bicknell E.J., в ходе которого было обследовано 29 пациентов, наблюдавшихся консервативно в течение в среднем 2,7 лет, и 17 прооперированных пациентов . У всех исходно и в ходе наблюдения был измерен уровень осмоляльности мочи в пробе с сухоедением, и ни у кого не было выявлено нарушения концентрационной функции почек. Авторы делают вывод, что, вероятнее всего, нарушение концентрационной функции почек характерно лишь для очень тяжелых форм заболевания, редко встречающихся в настоящее время, но не исключают того, что нарушение может развиться в ходе более длительного консервативного ведения . В работе Marx S.J. и соавт. была оценена осмоляльность мочи в пробе с сухоедением у 40 пациентов с пГПТ. В результате работы у всех пациентов было выявлено нарушение концентрационной функции почек при данном заболевании, причем у 18 прооперированных пациентов через месяц улучшения не отмечалось .
Таким образом, остается не вполне ясным от чего же зависит степень и наличие исходного нарушения и последующего восстановления концентрационной функции почек, каковы механизмы прогрессирования тубулопатии.
В настоящее время известно, что симптом полиурии связан в большей степени с гиперкальциурией, нежели чем с гиперкальциемией. Из клинических примеров известно, что полиурия может сопровождать гиперкаль-циурию различного генеза . Наоборот, при наследственной гипокальциурической гиперкальциемии, связанной с мутацией гена кальций-чувствительного рецептора (CASR), полиурии не наблюдается . Также известно, что у здоровых людей концентрация кальция в моче зависит не только от его суточного потребления, но и от питьевого режима. Например, кальциурия значительно возрастает при ограничении поступления воды, поскольку через стимуляцию вазопрессина возрастает реабсорбция воды в собирательных трубках нефрона. Считается, что именно поэтому частота мочекаменной болезни, во многом связанная с повышением кальциу-рии, выше в жарких засушливых регионах.
Нарушение концентрационной функции почек происходит по причине прямого токсического действия гиперкальциемии и гиперкальциурии на процессы канальцевой реабсорбции. Возникающая при этом полиурия может достигать 3-5 литров в сутки и привести к обезвоживанию организма, потере натрия, калия, магния и фосфатов.
Для лучшего понимания процессов сопряжения кальциевого и водного транспорта в нефроне необходимо глубже разобраться в процессах реабсорбции Са2+. У здорового человека экскретируется менее 2% профильтровавшегося в почечных клубочках кальция. Очевидно, что реабсорбция кальция очень интенсивна. Реабсорбция Са2+ осуществляется практически во всех отделах нефрона и регулируется посредством СЛБЯ, ПТГ, кальцитонина и кальцитриола . Стоит отметить, что регуляция очень тонко настроена, поскольку даже небольшая разница между поступающим в организм кальцием и экскретирующимся почками может привести к выраженному нарушению кальциевого баланса и кальциемии, если она будет сохраняться в течение многих дней.
Локальная регуляция экскреции Са2+ и сопряжение экскреции Са2+ с реабсорбцией №+ и воды обеспечивается СЛБЯ. СЛБЯ экспрессируется во многих отделах нефрона. Это и апикальная мембрана проксимального извитого канальца, и базо-латеральная мембрана кортикального и медуллярного дистального прямого канальца петли Генле и дистального извитого канальца, а также некоторых клеток кортикальных собирательных трубочек и, конечно, апикальная мембрана собирательной трубки внутренней зоны мозгового вещества. Имеются данные, что на всех участках СЛБЯ оказывает влияние на работу Ca2+/Mg2+ переносчиков .
В проксимальном извитом и проксимальном прямом канальце реабсорбируется примерно 70% профильтровавшегося Са. Этот процесс является изоосмотическим, то есть Са2+, №+ и вода реабсорбируются параллельно. Движущей силой реабсорбции является в начале (то есть
ОЖИРЕНИЕ И МЕТАБОЛИЗМ 1"2009
ОЖИРЕНИЕ И МЕТАБОЛИЗМ 1"2009
в более проксимальной части) концентрационный, затем электрохимический градиент . Примерно 1/5 Са реабсорбируется трансэпителиально . В целом проксимальный отдел нефрона, насколько это известно, не участвует во взаимосвязи обмена Са2+ и воды.
Петля Генле. Тонкие нисходящий и восходящий сегменты петли Генле практически непроницаемы для Са2+ и чрезвычайно проницаемы для Ка+ и воды. Однако проницаемым для Са2+ является дистальный прямой каналец петли Генле, в котором расположены ряд кальциевых каналов и КаК2С1-котранспортер. В этом последнем участке реабсорбируется около 20% профильтровавшегося кальция .
Большинство экспериментальных данных указывают на то, что реабсорбция кальция идет пассивно под действием положительного в просвете канальца электрохимического градиента. Основной механизм транспорта это параэпителиальный путь . Известно, что плотные контакты клеток этого участка (то есть межклеточная зона) включают белок парацеллин-1 (рагасеШи-1, РСЬК-1), вероятно, осуществляющий основной контроль над пассивной реабсорбцией Са (а заодно и Mg2+) . Данный вид транспорта зависит от транспорта Ка+, участвующего в создании трансэпителиального электрохимического градиента. Нарушение транспорта Ка+, например Ка+помпы, выводящей Ка+ из клетки с базо-латеральной стороны, напрямую влияет на реабсорбцию Са2+. Однако парацеллярный транспорт Са2+ не оказывает влияния на реабсорбцию Ка+. Подтверждением тому служит выявленное наследственное заболевание, связанное с гомозиготной мутацией РСЬК-1 и приводящее к повышенной ренальной потере Са2+ и Mg2+, но при сохранной реабсорбции Ка+ и С1-в этом сегменте (первичная гипомагнийемия) .
Однако есть данные и об активном транспорте Са2+ в дистальном прямом канальце кортикальных (коротких) петель Генле. Активный транспорт осуществляется трансэпителиально. Са2+ со стороны апикальной мембраны попадает в клетку под действием сильного концентрационного градиента, а с базо-латеральной стороны выводится из клетки с помощью Ка+/Са2+ обменника. Считается, что активность именно этого обменника регулируется ПТГ , правда, механизмы регуляции не вполне понятны.
В результате кальциевого транспорта и в зависимости от сывороточной концентрации Са2+ в интерстициальном пространстве базо-латеральной стороны канальца создается некоторая концентрация Са2+. Известно, что на базо-латеральной мембране эпителия дистального прямого канальца расположены СЛБЯ . Взаимодействие с ионами Са2+ оказывает ингибиторный эффект на КаК2С1 котранспортер апикальной мембраны, К+ ЯОМК каналы апикальной мембраны, обеспечивающие рециркуляцию К+, и на 3Ка+/2К+ обменник базо-латеральной мембраны . Вероятнее всего, влияние активации СЛБЯ обусловлено снижением продукции цАМФ и усилением его деградации, что и является причиной ингибирования К+каналов . Имеются данные, что стимуляция СЛБЯ также приводит к повышению продукции других молекул (например, 20-НЕТЕ), дополнительно инактивирующих
К+каналы . В результате указанных процессов снижается рециркуляция К+ и в соответствии с этим снижается транспорт Ка+, С1-, а следом за ними и Са2+, Mg2+ . Известно, что, активирующие мутации гена СЛБЯ являются причиной синдрома Бартера типа V, при котором наряду с гипокалиемическим метаболическим алкалозом имеется потеря Ка почками и компенсаторные гиперренинемия и гиперальдестеронизм . Вероятно, ролью СЛБЯ в этом сегменте в физиологических условиях является реакция на относительную гиперкальциемию. Меньшая реабсорбция натрия уменьшает трансэпителиальный электрохимический градиент (положительный в просвете, отрицательный с базо-латеральной стороны), а ведь именно он является основной движущей силой реабсорбции Са2+ в этом сегменте. Таким образом, реабсорбция кальция снижается. Описанный механизм отчасти аналогичен действию петлевых диуретиков, так как снижение реабсорбции Ка+ в дистальном прямом канальце снижает осмотический градиент, лежащий в основе функционирования противоточной системы. Однако выраженность оказываемого со стороны СЛБЯ ингибиторного влияния на вышеуказанные переносчики неизвестна.
Дистальный извитой каналец и соединительная трубка (связующий каналец). В дистальной части нефрона, состоящей из дистального извитого канальца и соединительной трубки реабсорбируется около 15% профильтровавшегося Са2+. В этих сегментах реабсорбция идет посредством активного трансцеллюлярного транспорта против имеющегося электрохимического градиента. Точное расположение зон, в которых идет транспорт, остается спорным. Известно, что большинство кальциевых каналов и переносчиков сосредоточено в дистальной трети дистального извитого канальца и в соединительной трубке . Точные механизмы регуляции этих переносчиков неизвестны. Есть данные, что активность транспорта Са2+ управляется ПТГ, кальцитонином и кальцитриолом . Например, ПТГ стимулирует Ка+/Са2+ обменник, находящийся на базо-латеральной мембране, так же как и в дистальном прямом канальце петли Генле , но предполагаются и множество других механизмов стимуляции ПТГ реабсорбции Са2+ . Также нет данных о том, чтобы концентрация Са2+ оказывала влияние на водный транспорт в этих сегментах.
Собирательные трубки. Собирательные трубки ответственны за реабсорбцию около 3% кальция. Транспорт Са2+ так же как и в дистальных канальцах происходит против электрохимического градиента и является активным. Известно, что переносчики Са2+ расположены на главных клетках (в этом отделе появляются также вставочные, отвечающие за кислотноосновное равновесие). Через кальциевые каналы Са2+ из просвета канальца попадет внутрь клетки канальцевого эпителия, далее с помощью ряда внутриклеточных белков-транспортеров Са2+ перемещается к базо-латеральной поверхности затем удаляется в интерстициальное пространство с помощью кальциевых помп . В исследовании транспорта Са2+ в собирательных трубочках внутренней зоны мозгового вещества у крыс методом микроперфузии установле-
но, что активность транспорта зависит от трансэпителиального концентрационного градиента Са2+ . По данным других исследований активность транспорта не менялась после тиропаратироидэктомии, то есть не зависела от уровня ПТГ и кальцитонина , и в эпителии собирательных трубок не было выявлено мРНК рецептора ПТГ и ПТГ-родственного пептида .
В исследовании Sands J. и соавт. проводившегося на крысах, было показано, что собирательные трубки внутренней зоны мозгового вещества содержат механизм, ослабляющий действие вазопрессина при повышении внутрипросветной концентрации Са2+ . Повышение внутрипросветной концентрации Са2+ от 1 до 5 ммоль/л в присутствии вазопрессина быстро (в течение 10 мин) и достоверно снижало проницаемость стенки канальца для воды на 30%. Данный эффект повторялся при использовании агониста CASR неоми-цина и частично устранялся после отмывания раствора, перфузирующего каналец. Использование специфических антител в том же исследовании показало, что у человека и у крыс CASR расположены, в основном, в дистальной трети собирательных трубок внутренней зоны мозгового вещества на апикальной мембране, так же как и водные каналы, аквапорин-2. И что, по всей видимости, передача сигнала обусловлена протеинкина-зой C, которая также присутствует в означенных клетках и является известным медиатором сигнала с CASR.
В другом исследовании, проведенном на крысах , было показано, что максимальная концентрационная способность почек при гиперкальциемии снижена примерно на 20% по сравнению с контролем за счет ослабления действия вазопрессина, даже после коррекции на повышенную продукцию простагландинов почками и снижение медуллярного осмотического градиента.
Помимо описанных выше механизмов у крыс с ПТГ-индуцированной гиперкальциемией наблюдалось повышение экспрессии гена CASR и снижение экспрессии генов многих переносчиков Na+ от проксимального извитого канальца до собирательных трубок, что сопровождалось снижением концентрационной способности почек, гипернатриурией, гиперкальциурией, гиперфос-фатурией . Выявленный эффект зависел от дозы введенного ПТГ. При имитации тяжелого гиперпаратиреоза подавление экспрессии генов - переносчиков Na+ было выраженным, что, по-видимому, и сыграло роль в развитии нарушения концентрационной функции почек, натриурии и фосфатурии. При введении меньшей дозы ПТГ концентрация мочи была снижена, но полиурии, натриуреза и снижения клубочковой фильтрации не было и снижение экспрессии отмечалось лишь для генов некоторых переносчиков. В другом исследовании было показано, что ПТГ также может снижать коэффициент клубочковой ультрафильтрации и, следовательно, скорость клубочковой фильтрации . В исследовании Wang W., et al, где у крыс гиперкальциемия была вызвана передозировкой витамина D, снижения экспрессии генов - переносчиков Na+ не было выявлено, так что возможно, что этот эффект обусловлен действием ПТГ, а не гиперкальциемией как таковой .
Описанным выше способом осуществляется сопряжение кальциевого и водного гомеостаза на уровне
почек. Физиологическая необходимость его кроется в том, чтобы препятствовать возникновению чрезмерной концентрации кальция в канальцевой жидкости и моче. Когда в результате избыточного поступления кальция в организм требуется повышение экскреции кальция почками, небольшие колебания концентрации кальция в перитубулярной интерстициальной жидкости приводят к CASR-опосредованному снижению транспорта КаС1 и Са2+ в дистальном прямом канальце петли Генле. Канальцевая жидкость с повышенным количеством КаС1, следовательно, воды и Са2+ достигает собирательных трубок внутренней зоны мозгового вещества, где в условиях максимальной стимуляции вазопрессином все же возникает вероятность вновь возрастания концентрации кальция и образования кальциевых оксалатных или фосфатных мочевых камней. Избежать этого помогает второй механизм, который снижает эффективность действия вазопрессина на реабсорбцию воды и мешает концентрации кальция вновь вырасти. Вариации в количестве переносчиков Ка+ и CASR также способствуют снижению концентрационной способности почек. Таким образом, на всех участках нефрона, особенно на тех, которые связаны с активной реабсорбцей воды, концентрация Са2+ поддерживается на уровне, не допускающем камнеобразования.
В условиях патологической гиперкальциурии воздействие Са2+ на СЛБЯ на уровне петли Генле повышает объем внутриканальцевой жидкости, а на уровне собирательных трубок дополняется фактическим развитием почечной формы несахарного диабета, то есть связанной с резистентностью почек к вазопрессину.
Реализация вышеописанных механизмов в условиях пГПТ приводит к обезвоживанию организма в целом. В легких случаях обезвоживание может быть компенсировано повышенным потреблением жидкости и даже оставаться незамеченным для пациента. Однако в тяжелых случаях высокой гиперкальциемии (общий Са сыворотки выше 3,5 ммоль/л) дегидратация организма становится важным патофизиологическим компонентом тяжелого состояния пациентов. Общему обезвоживанию организма могут также способствовать рвота и голодание вследствие потери аппетита и общей заторможенности. При гиперкальциемическом кризе обезвоживание может достигать таких значений, что за счет снижения скорости клубочковой фильтрации полиурическая стадия может перейти в олигоури-ческую. Именно поэтому лечение высокой гиперкаль-циемии, основная цель которого состоит в максимально быстром снижении уровня кальция крови, необходимо начинать с восполнения объема циркулирующей крови. Только после регидратации организма и восстановления диуреза, если он был снижен, рекомендуется проведение форсированного диуреза, так как повышение натрийурии усиливает кальциурию, и специфической гипокальциемической терапии.
Одним из самых интригующих аспектов обсуждаемой проблемы остается то, что выраженность наблюдаемого нарушения концентрационной функции почек сильно варьирует в пределах примерно одинаковой гиперкальциурии и гиперкальциемии в рамках пГПТ. Одним из возможных объяснений этому фено-
ОЖИРЕНИЕ И МЕТАБОЛИЗМ 1"2009
ОЖИРЕНИЕ И МЕТАБОЛИЗМ 1"2009
мену может стать полиморфизм гена CASR, связанный с чуть большей или чуть меньшей чувствительностью рецептора к Са2+. В настоящее время выявлено несколько полиморфных вариантов гена CASR, наблюдающихся у здоровых людей и у пациентов с мочекаменной болезнью. Относительно одного из гаплотипов было показано, что его наличие в гомо-гетерозиготном положении коррелирует с концентрацией Са2+ сыворотки крови , в то время как другой гаплотип ассоциирован с повышенным риском мочекаменной болезни . Данные исследования наглядно демонстрируют, что от полиморфного варианта гена CASR зависит обмен кальция индивидуального организма. Следовательно, от него может зависеть и выраженность реакции почек на гиперкальцие-мию/гиперкальциурию.
Подводя итоги обзора можно сказать, что ухудшение концентрационной функции почек является несомненным симптомом гиперкальциурии / гиперкальциемии. Также, возможно, непосредственный вклад в развитие
синдрома вносит повышенный уровень ПТГ. Несмотря на то, что выраженность снижения концентрационной функции почек может сильно варьировать, обезвоживание всегда имеет место при значительном повышении уровня кальция в крови и моче. Почечные механизмы данного патологического состояния реализуются в основном через активацию CASR ионами Са2+ в различных участках нефрона. В первую очередь дистального прямого канальца петли Генле и собирательных трубочек. Физиологический смысл которых состоит в препятствовании чрезмерному возрастанию концентрации Са2+ в канальциевой жидкости и снижении риска кам-необразования. В статье рассмотрены механизмы обратимого повреждения почек при пГПТ, являющихся прямым следствием характерных метаболических сдвигов. В редких случаях тубулопатия сохраняется даже после радикального излечения пГПТ. Почему возникают глубокие нарушения, а также причины столь различной индивидуальной реакции на гиперкальциемию / гипер-кальциурию при пГПТ еще предстоит выяснить.
Литература
1. Bengele H, Alexander E, Lechene C. Calcium and magnesium transport along the inner medullary collecting duct of the rat. Am J Physiol Renal Fluid Electrolyte Physiol. - 1980 - 239 (1) - pp.24-9.
2. Blanchard A, Jeunemaitre X, Coudol P, et al. Paracellin-1 is critical for magnesium and calcium reabsorption in the human thick ascending limb of Henle. Kidney Int - 2001 - 59(6) - pp. 2206-2215.
3. Blaustein M, Lederer W. Sodium/Calcium Exchange: Its Physiological Implications. Physiol Rev. - 1999 - 79(3) - pp. 763-854.
4. Bourdeau J, Burg M. Effect of PTH on calcium transport across the cortical thick ascending limb of Henle"s loop. Am. J. Physiol. - 1980 - 239 (2) - pp. 121-6.
5. Edvall CA. Renal function in hyperparathyroidism. Acta Chir Scand. -1958 -229 (Suppl) - pp. 5-56.
6. Egbuna O, Brown E Hypercalcaemic and hypocalcaemic conditions due to calcium-sensing receptor mutations. Best Pract Res Clin Rheumatol. - 2008 -22(1)-pp. 129-48.
7. Ellis G, Spirtos G, Polsky F. Primary hyperparathyroidism and coexisting nephrogenic diabetes insipidus: rapid postoperative correction. South Med .J- 1991 -84(8) - pp. 1019-22.
8. Fenton R, Knepper M. Mouse Models and the Urinary Concentrating Mechanism in the New Millennium. Physiol Rev. - 2007 - 87(4) - pp. 1083-1112.
9. Hebert S, Desir G, Giebisch G, Wang W. Molecular Diversity and Regulation of Renal Potassium Channels. Physiol. Rev. - 2005 - 85(1) -pp. 319-371.
10. Hedback G, Abrahamsson K, Oden A. The improvement of renal concentration capacity after surgery for primary hyperparathyroidism. Eur J Clin Invest - 2001 -31 - pp. 1048-53.
11. Hedback G, Oden A. Death risk factor analysis in primary hyperparathyroidism. Eur J Clin Invest - 1998 - 28 (12) - pp. 1011-1018.
12. Hedback G, Oden A. The increased risk of death of primary hyperparathyroidism, an update. Eur J Clin Invest - 1998 - 28(4) - pp. 271-6.
13. Hellstrom J, Ivemark B. Primary hyperparathyroidism, clinical and structural findings in 138 cases. Acta Chir Scand. - 1962 - 294(Suppl) - pp. 7-60.
14. Hoenderop J, Nilius B, Bindels R. Calcium Absorption Across Epithelia. Physiol. Rev. - 2005 - 85(1) - pp. 373-422.
15. van"t Hoff W, Bicknell E. Renal tubular function in hyperparathyroidism. Postgraduate Med J. - 1989 - 65 (769) - pp. 811-3.
16. Jansson S, Morgan E. Biochemical Effects from Treatment with Bisphosphonate and Surgery in Patients with Primary Hyperparathyroidism. World J Surg. -
2004 - 28(12) - pp. 1293-97.
17. Kashitani T, Makino H, Nagake Y et al. Two cases of hypercalcemic nephropathy associated with primary hyperparathyroidism. Nippon Jinzo Gakkai Shi. - 1993 -35(10) - pp. 1189-94.
18. Kausalya P, Amasheh S, et al. Disease-associated mutations affect intracellular traffic and paracellular Mg2+ transport function of claudin-16. J Clin Invest. -2006 - 116(4) - pp. 878-891.
19. Kukora J, ZeigerM, et al. The American Association of Clinical Endocrinologists and the American Association of Endocrine Surgeons position statement on the
diagnosis and management of primary hyperparathyroidism. Endocr. Practice -
2005 - 11 (1) - pp. 49-54.
20. Kushner D Calcium and the kidney. Am J Clin Nutrition. -1986- 4 (5)-pp. 561-679.
21. Lee K, Brown D, et al. Localization of parathyroid hormone/parathyroid hormone-related peptide receptor mRNA in kidney. Am J Physiol Renal Fluid Electrolyte Physiol. - 1996 - 270 - pp. 186-91
22. Levi M, Peterson L, Berl T. Mechanism of concentrating defect in hypercalcemia. Role of polydyspsia and prostaglandins. Kidney Int. - 1983 - 23 - pp.489-97.
23. Magaldi A, van Baak A, Rocha A. Calcium transport across rat inner medullary collecting duct perfused in vitro. Am J Physiol Renal Fluid Electrolyte Physiol. -1989 - 257 - pp.738-45.
24. Marx S, Attie M. Maximal urine-concentrating ability: familial hypocalciuric hypercalcemia versus typical primary hyperparathyroidism. J Clin Endocrinol Metab. -1981 - 52(4) - pp.736-40.
25. Poujeol P, Bidet M, Tauc M. Calcium transport in rabbit distal cells. Kidney Int. -1995 - 48 - pp. 1102-1110.
26. Sands J, Naruse M, et al. Apical Extracellular Calcium/Polyvalent Cation-sensing Receptor Regulates Vasopressin-elicited Water Permeability in Rat Kidney Inner Medullary Collecting Duct. J Clin Invest. - 1997 - 99(6) - pp.1399-1405.
27. Schor N, Ichikawa I, Brenner B. Mechanisms of action of various hormones and vasoactive substances on glomerular ultrafiltration in the rat. Kidney Int. - 1981 -20- pp. 442-51.
28. Scillitani A, Guarnieri V, Battista C, et al. Primary hyperperethyroidism and the presence of kidney stones are associated with different haplotypes of the calcium-sensing receptor J Clin Endocrinol Metab. - 2007 - 92(1) - pp. 277-83.
29. Scillitani A, Guarnieri V, De Geronimo S, et al. Blood ionized calcium is associated with clustered polymorphisms in the carboxyl-terminal tail of the calcium-sensing receptor. J Clin Endocrinol Metab. - 2004 - 89 - pp.5634-38.
30. Vargas-Poussou R, Huang C, et al. Functional characterization of a calcium-sensing receptor mutation in severe autosomal dominant hypocalcemia with a Bartter-like syndrome. J Am Soc Nephrol. - 2002 - 13 -pp. 2259-2266.
31. Vezzoli G, Tanini A, Ferrucci L, et al. Influence of the calcium-sensing receptor gene on urinary calcium excretion in stone forming patients. J Am Soc Nephrol. -2002 - 13 - pp. 2517-23.
32. Wang W, Kwon T, et al. Reduced expression of Na-K-2Cl cotransporter in medullary TAL in vitamin D-induced hypercalcemia in rats. Am J Physiol Renal Physiol. - 2002 - 282 - pp.34-44.
33. Wang W, Lu M, Hebert S. Cytochrome P-450 metabolites mediate extracellular Ca2+-induced inhibition of apical K+ channels in the TAL. Am J Physiol Cell Physiol - 1996 - 271- pp. 103-111.
34. Watanabe S, Fukumoto S, et al. Association between activating mutations of calcium-sensing receptor and Bartter"s syndrome. Lancet - 2002 - 360 -pp. 692-694.
35. Weidong W, Chunling L, et al. Reduced expression of renal Na+ transporters in rats with PTH-induced hypercalcemia. Am J Physiol Renal Physiol. - 2004 -286 - pp.534-45.
Структурной единицей почек является нефрон, который отвечает за процесс фильтрации крови. В двух мочевыделительных органах собрано около двух миллионов нефронов, которые сплетаются группами в небольшие клубочки. Это и есть клубочковый аппарат (гломерулярный), в котором происходит клубочковая фильтрация почек.
Важно: в течение суток через нефроновые клубочки проходит от 120 до 200 литров крови. При этом именно в нефронах происходит отделение всех токсинов и продуктов распада белков, углеводов и жиров.
Принцип протекания фильтрационного процесса
Процесс фильтрации почек достаточно прост и понятен. Сначала кровь, обогащенная кислородом и другими питательными веществами, попадает в почки, а именно в клубочковый аппарат. В нефронах, которые имеют своеобразное «сито», происходит отделение токсических веществ и других продуктов распада от воды. После такого деления вода и полезные микроэлементы (глюкоза, натрий, калий) всасываются обратно. То есть происходит процесс реабсорбции. А все токсины продолжают свое движение через нефроновые канальцы к почечным пирамидкам и далее в чашечно-лоханочную систему. Здесь уже формируется вторичная моча, которая и выходит через мочеточники, мочевой пузырь и уретру.
Важно: стоит знать, что если почки человека больны, то нефроны в них медленно погибают один за другим. Таким образом, фильтрующая функция мочевыделительных органов постепенно снижается. При этом необходимо помнить, что нефроны, как и нервные клетки, восстановлению не подлежат. А те нефроны, которые принимают на себя двойную и тройную нагрузку, со временем перестают справляться со своей функцией и скоро выходят из строя.
Факторы, которые могут влиять на изменение СКФ

Скорость происходящей фильтрации в клубочковом аппарате зависит от таких факторов:
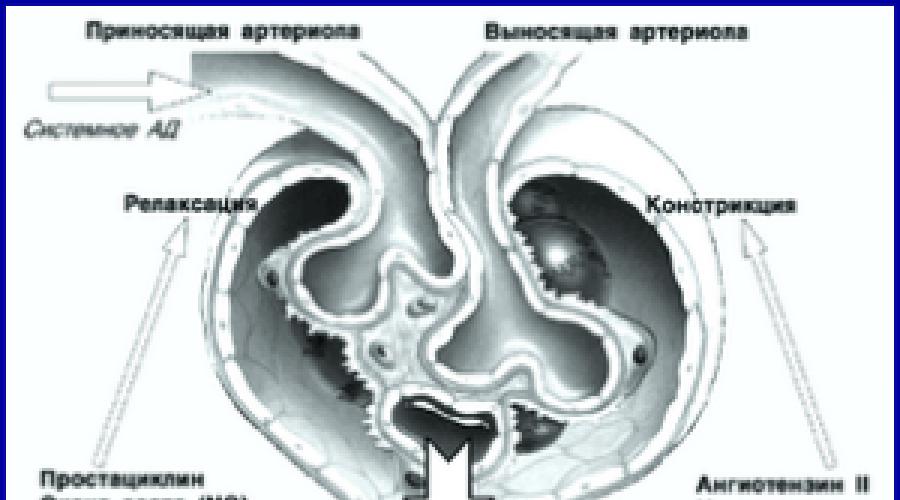
- Скорость транспортировки плазмы по почечному клубочковому аппарату. То есть, подразумевается объем крови, проходящий через поясничную артериолу за определенную единицу времени. В норме этот показатель составляет 600 мл/мин для человека со средней массой 70 кг.
- Показатель давления в сосудистой системе организма. Для нормального и здорового организма характерно более высокое давление в сосуде приносящем, чем в сосуде выносящем. В противном случае процесс фильтрации будет затруднен, а его скорость снижена.
- Количество здоровых нефронов. Чем более почка поражена патологическим состоянием, тем меньшей становится фильтрующая площадь. То есть количество здоровых нефронов снижается.
Оценка СКФ
blocquoteblue>Важно: в норме фильтрация почек у здоровых органов происходит с постоянной скоростью и остается неизменной вплоть до развития в мочевыделительных органах патологических процессов.
Патологии, которые определяют СКФ

Патологические процессы, меняющие скорость клубочковой фильтрации почек в меньшую сторону, могут быть самыми разнообразными. В частности на СКФ влияют такие патологии и болезни:
- Хроническая почечная недостаточность. В этом случае в моче будет отмечаться и повышенная концентрация креатинина и мочевины. То есть почки не справляются со своей фильтрационной функцией.
- Пиелонефрит. Эта воспалительно-тнфекционная болезнь в первую очередь поражает канальцы нефронов. И лишь затем происходит спад СКФ.
- Сахарный диабет. А также при гипертензии (повышенное АД), красной волчанке наблюдается увеличенная скорость процесса фильтрации почек.
- Гипотензия (сниженное АД). А также шоковое состояние и сердечная недостаточность могут провоцировать снижение СКФ до значительных пределов.
Помощь в диагностике болезней

Измерение СКФ даёт возможность выявить различные болезни и патологические состояния на ранних стадиях. При этом чтобы отследить процесс фильтрации в почках часто используют метод введения в кровь инулина - специального контрольного вещества, которое выводится через клубочковый аппарат. Инулин вводят постоянно на время исследования, чтобы поддерживать постоянную его концентрацию в крови.
Забор мочи на анализ при поддержании уровня инулина проводят четырежды с интервалом полчаса. Но стоит знать, что этот способ анализа состояния почек достаточно сложен и применим исключительно в научных целях.
Также можно оценить СКФ и по уровню клиренса креатинина, который напрямую зависит от мышечной массы тела пациента. Здесь стоит знать, что у активных мужчин клиренс креатинина значительно выше, чем у женщин и детей. Отметим, что креатинин выходит из организма исключительно через клубочковый аппарат. Поэтому, если процесс фильтрации в почках нарушен, концентрация креатинина в моче повышается и составляет 70% в сравнении с СКФ.
Важно: при проведении исследования мочи на креатинин необходимо знать, что лекарственные препараты могут сильно искажать результат. В норме же уровень креатинина для мужчин составляет 18-21 мг/кг, а у женщин 15-18 мг/кг. Если показатели снижены, это может свидетельствовать о сбое в работе почек.

Эта методике исследования работы мочевыделительных органов осуществляется таким образом:
- Утром больному предлагают выпить натощак пол-литра воды. После этого он должен каждый час мочиться, чтобы собирать порции биоматериала в отдельные ёмкости.
- При мочеиспускании пациент обязан засекать время начала и окончания акта.
- А в промежутке между забором порций мочи у пациента берут кровь из вены, чтобы определить клиренс креатинина. Его высчитывают по специальной формуле. Формула расчета имеет такой вид — F1=(u1/p)v1.
Здесь значения имеют такие трактования:
- Fi - это клубочковая фильтрация (её скорость);
- U1 - содержание в крови контрольного вещества;
- Vi – время самого первого после прима воды мочеиспускания (в минутах)
- р - концентрация креатинина в плазме крови.
Высчитывают клиренс креатинина по приведенной формуле каждый час. При этом вычисления проводятся в течение суток.
Это интересно: в норме у мужчин СКФ равна 125 литров/мин, а у женщин - 110 мл/мин.
Расчет СКФ у детей

Чтобы рассчитать скорость клубочковой фильтрации у детей, применяют формулу Шварца. В первом случае у маленького пациента на голодный желудок делают забор крови из вены. Она необходима для определения уровня креатинина в плазме крови. На фоне взятого биоматериала у малыша собирают и две порции мочи с интервалом в час. И также засекают длительность акта мочеиспускания в минутах или секундах. Расчеты по формуле Шварца дают возможность получить два значения СКФ.
Для второго способа вычислений у маленького пациента собирают суточный объем мочи с часовыми интервалами. Здесь объем должен составлять не менее 1,5 л. Если при проведении расчетов результат скорости клубочковой фильтрации равен 15 мл/мин (то есть сильно понижен), то это говорит о почечной недостаточности или хронических болезнях почек.
Важно: СКФ может падать не всегда на фоне гибели нефронов. Часто скорость фильтрации может снижаться на фоне протекающего в почках воспалительного процесса. Именно поэтому при первых же подозрительных симптомах (боль в пояснице, потемнение мочи, отечность) необходимо срочно обращаться к нефрологу или урологу.
Лечение почек и восстановление скорости фильтрации
При выявленных нарушениях фильтрационной функции почек лечение должен назначать только специалист в зависимости от первопричины, приведшей к патологии. В большинстве случаев улучшить ситуацию помогают препараты «Теобромин» и «Эуфиллин». Они усиливают диурез, что приводит к нормализации СКФ.
Также на фоне лечения необходимо соблюдать диету и питьевой режим. В сутки стоит выпивать до 1,2 литра жидкости. А из рациона стоит исключить все жареное, жирное, соленое, острое, копченое. Будет лучше, если на время лечения пациент перейдет на парные и отварные блюда.
Если разрешит лечащий врач, то скорректировать скорость клубочковой фильтрации можно и народными средствами. Так, хорошо увеличивает СКФ обычная петрушка, улучшающие диурез свойства которой известны издавна. Её сухие семена и корни (в объеме 1 ст.л.) запаривают кипятком (500 мл) и выдерживают 2-3 часа. Затем настой цедят и пьют дважды в течение дня по 0,5 стакана.
Также, чтобы повысить СКФ, можно использовать и корень шиповника. Его в количестве 2 ст.л. заливают кипятком и варят на небольшом огне 15 минут. Потом отвар цедят и выпивают по 70 мл три раза в течение дня. Такое снадобье также повышает диурез, что обязательно увеличит и СКФ
Важно знать, что весь процесс лечения должен контролировать только специалист. Заниматься самолечением строго запрещено.
lecheniepochki.ru
Фильтрация крови в почках
Чтобы понять механизм очистки крови и образования мочи, нужно иметь представление об устройстве почки. Этот парный орган состоит из огромного количества нефронов, в которых и происходит мочеобразование.
Основными почечными функциями являются:
Мочеобразование; Очистка крови, выведение лекарств, метаболитов и пр.; Регулирование обмена электролитов; Контроль за давлением и объемом циркулирующей крови; Поддержание кислотно-щелочного баланса.
Фактически почки являются безостановочно функционирующими фильтрами, которые обрабатывают до 1,2 л крови за минуту.
Каждая почка имеет бобовидную форму. На каждой почке имеется своеобразная впадина, которую еще называют воротами. Они ведут в заполненное жировой массой пространство или пазуху. Там же располагается чашечно-лоханочная система, нервные волокна и сосудистая система. Из этих же ворот выходят вена и артерия почки, а также мочеточник.
Каждая почка состоит из множества нефронов, которые представляют собой комплекс из канальцев и клубочка. Фильтрация крови происходит непосредственно в почечном тельце или клубочке. Именно там моча отфильтровывается от крови и уходит в мочевой пузырь.
На видео строение почек
Где происходит
Почка как бы помещена в капсулу, под которой располагается зернистый слой, называемый корковым веществом, а под ним располагается мозговое вещество. Мозговой слой складывается в почечные пирамидки, между которыми располагаются колонны, расширяющиеся в сторону почечных пазух. На вершинах этих пирамид располагаются сосочки, которые опустошают пирамиды, выводя их содержимое в малые чашечки, затем в большие.
У каждого человека число чашечек может отличаться, хотя в целом 2-3 больших чашки разветвляются на 4-5 малых чашечек, причем одна малая чашечка обязательно окружает сосочек пирамиды. Из малой чашечки урина попадает в большую, а потом – в мочеточник и мочепузырные структуры.
Кровь поставляется в почки по почечной артерии, которая разветвляется на меньшие сосуды, затем кровь проникает в артериолы, разделяющиеся на 5-8 капилляров. Так кровь попадает в клубочковую систему, где и осуществляется процесс фильтрации.
Схема почечной фильтрации
Клубочковая фильтрация - определение
Фильтрация в клубочках почек происходит по простому принципу:
Сначала из клубочковых мембран под гидростатическим давлением происходит отжим/фильтрация жидкости (≈125 мл/мин); Затем отфильтрованная жидкость проходит через нефроны, большая ее часть в виде воды и необходимых элементов возвращается в кровь, а остальное формируется в мочу; Средняя скорость образования мочи – порядка 1 мл/мин.
Клубочек почки производит фильтрацию крови, очищая ее от различных белков. В процессе фильтрации и происходит образование первичной мочи.
Основной характеристикой процесса фильтрации является его скорость, которая обуславливается факторами, влияющими на почечную деятельность и общим состоянием здоровья человека.
Скоростью клубочковой фильтрации называют объем первичной урины, образующейся в почечных структурах за минуту. Нормой считается скорость фильтрации 110 мл/мин у женщин и 125 мл/мин у мужчин. Эти показатели выступают своего рода ориентирами, которые подвергаются коррекции в соответствии с весом, возрастом и прочими показателями пациента.
Схема клубочковой фильтрации
Нарушения фильтрации
За сутки нефроны отфильтровывают до 180 л первичной мочи. Вся кровь в организме за сутки успевает очиститься почками 60 раз.
Но некоторые факторы способны спровоцировать нарушение процесса фильтрации:
Снижение давления; Нарушения мочеоттока; Сужение артерии почки; Травматизация или повреждение мембраны, выполняющей фильтрующие функции; Повышение онкотического давления; Уменьшение числа «рабочих» клубочков.
Подобные состояния чаще всего становятся причиной нарушений фильтрации.
Как определить нарушение
Нарушение фильтрационной деятельности определяется посредством расчета ее скорости. Определить насколько в почках ограничена фильтрация можно по различным формулам. В целом процесс определения скорости сводится к сравнению уровня определенного контрольного вещества в моче и крови пациента.
Обычно в качестве сравнительного эталона используется инулин, являющийся полисахаридом фруктозы. Его концентрацию в моче сравнивают с содержанием в крови, а затем высчитывают содержание инсулина.
Чем больше инулина в урине по соотношению с его уровнем в крови, тем больше объем отфильтрованной крови. Этот показатель еще именуют инулиновым клиренсом и рассматривают в качестве величины очищенной крови. Но как рассчитать скорость фильтрации?
Формула расчета скорости клубочковой фильтрации почек выглядит следующим образом:
СКФ (мл/мин),
где Мин – количество инулина в моче, Пин – содержание инулина в плазме, Vмочи – объем конечной урины, а СКФ – скорость клубочковой фильтрации.
Почечная деятельность также может высчитываться по формуле Кокрофта-Голта, которая выглядит так:
При измерении фильтрации у женщин, полученный результат нужно помножить на 0,85.
Довольно часто в клинических условиях при измерении СКФ используется клиренс креатинина. Подобное исследование еще называют пробой Реберга. Ранним утром пациент выпивает 0,5 литра воды и сразу опорожняет мочевой пузырь. После этого каждый час нужно мочеиспускаться, собирая мочу в разные емкости и отмечая длительность каждого мочеиспускания.
Затем исследуют венозную кровь и по специальной формуле вычисляют клубочковую фильтрацию:
Fi = (U1/p) х V1,
где Fi – клубочковая фильтрация, U1 – содержание контрольного компонента, р – уровень креатинина в крови, а V1 – длительность исследуемого мочеиспускания. По данной формуле каждый час производится расчет, на протяжении суток.
Симптомы
Признаки нарушения клубочковой фильтрации обычно сводятся к изменениям количественного (увеличение или уменьшение фильтрации) и качественного (протеинурия) характера.
К дополнительным признакам относят:
Понижение давления; Почечные застои; Гиперотечность, особенно в области конечностей и лица; Мочеиспускательные нарушения вроде урежения или учащения позывов, появление нехарактерного осадка или цветовые изменения; Боли в поясничной зоне Накопление в крови разного рода метаболитов и пр.
Падение давления обычно возникает при шоковых состояниях или недостаточности миокарда.
Симптомы нарушения клубочковой фильтрации в почках
Как улучшить фильтрацию
Восстановить фильтрацию почек крайне необходимо, особенно если имеет место стойкая гипертония. Вместе с мочой из организма вымываются излишки электролитов и жидкости. Именно их задержка и вызывает повышение АД.
Для улучшения почечной деятельности, в частности клубочковой фильтрации, специалисты могут назначить прием препаратов вроде:
Теобромина – слабый диуретик, который за счет увеличения почечного кровотока повышает фильтрационную деятельность; Эуфиллина – тоже диуретик, содержащий теофиллин (алкалоид) и этилендиамид.
Помимо приема препаратов необходимо привести в норму общее самочувствие пациента, восстановить иммунитет, нормализовать давление и пр.
Для восстановления почечных функций необходимо также сбалансированно питаться и соблюдать распорядок дня. Только комплексный подход поможет нормализовать фильтрационную деятельность почек.
Неплохо помогают в повышение почечной деятельности и народные методы вроде арбузной диеты, шиповникового отвара, мочегонных отваров и травяных настоев, чаев и пр. Но перед тем что бы что-то делать, нужно после консультации с нефрологом.
Клубочковая фильтрация - одна из основных характеристик, отображающих деятельность почек. Фильтрационная функция почек помогает врачам в диагностике заболеваний. Скорость клубочковой фильтрации указывает, есть ли повреждения клубочков почек и степень их поражения, определяет их функциональные возможности. Во врачебной практике существует множество методов определения этого показателя. Давайте разберемся, в чем их суть и которые из них самые эффективные.

Что это такое?
В здоровом состоянии в структуре почки насчитывается 1−1,2 миллиона нефронов (составляющие почечной ткани), которые связываются с кровотоком через кровеносные сосуды. В нефроне находится клубочковое скопление капилляров и канальцы, которые принимают непосредственное участие в образовании урины - очищают кровь от продуктов обмена и корректируют ее состав, то есть в них фильтруется первичная моча. Этот процесс называется клубочковой фильтрацией (КФ). За день фильтруются 100−120 литров крови.
 Схема клубочковой фильтрации почек.
Схема клубочковой фильтрации почек.
Чтобы дать оценку работе почек, очень часто используется значение скорости клубочковой фильтрации (СКФ). Она характеризует количество выработанной первичной урины за единицу времени. Норма скоростных показателей фильтрации находится в пределах от 80 до 125 мл/мин (женщины - до 110 мл/мин, мужчины - до 125 мл/мин). У людей пожилого возраста показатель ниже. Если же у взрослого человека обнаружена СКФ ниже 60 мл/мин, это первый сигнал организма о начале развития хронической почечной недостаточности.
Вернуться к оглавлению
Факторы, меняющие скорость клубочковой фильтрации почек
Скорость клубочковой фильтрации определяют несколько факторов:
Скорость течения плазмы в почках - количество крови, которое притекает за единицу времени через приносящую артериолу в почечном клубочке. Нормальным показателем, если человек здоров, является 600 мл/мин (подсчет сделан на основе данных о среднестатистическом человеке, весом 70 кг).Уровень давления в сосудах. В норме, когда организм здоров, давление в приносящем сосуде выше, чем в выносящем. Иначе не происходит процесс фильтрации.Количество работоспособных нефронов. Есть патологии, которые влияют на клеточную структуру почки, вследствие чего сокращается количество дееспособных нефронов. Такое нарушение в дальнейшем вызывает сокращение площади фильтрационной поверхности, от размеров которой напрямую зависит СКФ.Вернуться к оглавлению
Проба Реберга-Тареева
 Достоверность пробы зависит от времени, когда был собран анализ.
Достоверность пробы зависит от времени, когда был собран анализ.
Проба Реберга-Тареева исследует уровень клиренса выработанного организмом креатинина - объем крови, из которого возможно отфильтровать почками 1 мг креатинина за 1 минуту. Измерить количество креатинина можно в свернувшейся плазме и моче. Достоверность исследования зависит от времени, когда анализ был собран. Исследование зачастую проводится так: урина собирается 2 часа. В ней замеряется уровень креатинина и минутный диурез (объем урины, который образуется за минуту). СКФ рассчитывают на основе полученных значений этих двух показателей. Менее часто используется метод сбора мочи за сутки и 6-часовые пробы. Независимо от того, какую методику использует врач, у пациента сутра, пока он не позавтракал, забирают кровь из вены для проведения исследования на клиренс креатинина.
Проба на клиренс креатинина назначается в таких случаях:
болезненные ощущения в районе почек, отеки век и щиколоток;нарушение испускания мочи, урина темного цвета, с кровью;необходимо установить верную дозу медикаментов для терапии заболеваний почек;диабет 1 и 2 типа;гипертония;абдомиальное ожирение, синдром резистентности к инсулину;злоупотребление курением;сердечно-сосудистые заболевания;перед операцией;болезни почек в хронической форме.Вернуться к оглавлению
Проба Кокрофта-Голда

Проба Кокрофта-Голда тоже устанавливает концентрацию креатинина в сыворотке крови, но отличается от описанной выше методикой забора материалов для анализа. Проба проводится так: сутра натощак пациент пьет 1,5−2 стакана жидкости (вода, чай), чтобы активизировать выработку урины. Через 15 минут больной справляет малую нужду в унитаз, чтобы очистить мочевой пузырь от остатков образований во время сна. Далее положен покой. Через час производится первый забор мочи и фиксируется его время. Вторая порция собирается в следующий час. Между этим у пациента производится забор крови из вены по 6−8 мл. Далее по полученным результатам определяется клиренс креатинина и количество урины, которое образуется за минуту.
Вернуться к оглавлению
Скорость клубочковой фильтрации по формуле MDRD
В данной формуле учитывается пол и возраст пациента, поэтому с ее помощью очень легко наблюдать как меняются почки с возрастом. Очень часто используется для диагностики нарушений функций почек у беременных. Сама формула выглядит так: СКФ = 11,33 * Crk - 1,154 * возраст - 0,203 * K, где Crk - количество креатинина в крови (ммоль/л), K - коэффициент, зависящий от пола (у женщин - 0,742). В том случае, если этот показатель в заключении анализа подан в микромолях (мкмоль/л), то его значение необходимо поделить на 1000. Главный недостаток этого метода расчета - неверные результаты при повышенной КФ.
Вернуться к оглавлению
Причины снижения и повышения показателя

Существуют физиологические причины изменения СКФ. Во время беременности уровень повышается, а когда организм стареет - понижается. Также провоцировать повышение скорости способна пища с большим содержанием белка. Если же у человека наблюдается патология почечных функций, то КФ способна как увеличиваться, так и снижаться, все зависит от конкретного заболевания. СКФ является наиболее ранним указателем нарушения функционирование почек. Интенсивность КФ снижается намного быстрее, чем теряется способность почек концентрировать мочу и в крови накапливаются азотистые шлаки.
Когда почки больны, сниженную фильтрацию крови в почках провоцируют нарушения структуры органа: снижается количество активных структурных единиц почки, коэффициент ультрафильтрации, происходят изменения в почечном кровотоке, уменьшается фильтрующая поверхность, происходит обструкция канальцев почек. Ее вызывают хронические диффузные, системные заболевания почек, нефросклероз на фоне артериальной гипертензии, острая печеночная недостаточность, тяжелая степень заболеваний сердца, печени. Кроме болезней почек, на СКФ влияют экстраренальные факторы. Снижение скорости наблюдается вместе с сердечной и сосудистой недостаточностью, после приступа сильной диареи и рвоты, при гипотиреозе, раковых заболеваниях простаты.
Повышение СКФ - более редкое явление, но проявляется при сахарном диабете на ранних стадиях, гипертонии, системном развитии красной волчанки, в начале развития нефротического синдрома. Также повысить скорость КФ способны медикаменты, которые влияют на уровень креатинина (цефалоспорин и похожие по действию на организм). Лекарство повышает его концентрацию в крови, поэтому при взятии анализа выявляются ложноповышенные результаты.
Вернуться к оглавлению
Нагрузочные пробы
 Нагрузка белками - это употребление необходимого количества мяса.
Нагрузка белками - это употребление необходимого количества мяса.
В основе нагрузочных проб лежит способность почек к ускорению клубочковой фильтрации под влиянием определенных веществ. С помощью такого исследования определяется резерв КФ или почечный функциональный резерв (ПФР). Чтобы его узнать, применяется одноразовая (острая) нагрузка белком или аминокислотами либо они заменяются небольшим количеством допамина.
Нагрузка белками заключается в изменении рациона. Необходимо употребить 70−90 грамм белка из мяса (1,5 грамма белка на 1 килограмм массы тела), 100 грамм белков растительного происхождения или ввести аминокислотный набор внутривенно. У людей без проблем со здоровьем отмечается повышение СКФ на 20−65% уже через 1−2,5 часа после получения дозы белков. Среднее значение ПФР равно 20−35 мл в минуту. Если повышения не происходит, то, скорее всего, у человека нарушена проницаемость почечного фильтра или развиваются сосудистые патологии.
Вернуться к оглавлению
Важность проведения исследований
Важно следить за СКФ людям с такими заболеваниями:
хроническое и острое течение гломерулонефрита, а также его вторичное появление;почечная недостаточность;воспалительные процессы, спровоцированные бактериями;поражение почек в результате системной красной волчанки;нефротический синдром;гломерулосклероз;почечный амилоидоз;нефропатия при диабете и т. д.
Эти болезни вызывают снижение СКФ задолго до проявления каких-либо функциональных нарушений почек, повышения уровня креатинина и мочевины в крови больного. В запущенном состоянии заболевания провоцируют необходимость пересадки почек. Поэтому чтобы предупредить развитие каких-либо патологий почек, необходимо регулярно проводить исследования их состояния.
no-gepatit.ru
Ультрафильтрация плазмы с образованием первичной мочи осуществляется в клубочках почек.
Фильтрующая мембрана клубочка состоит из трех слоев: эндотелия капилляров, базальной мембраны и эпителиальных клеток внутренней части капсулы, которые называются подоцитами. Подоциты имеют отростки, плотно упирающиеся в базальную мембрану. Структура базальной мембраны сложная, в частности она содержит мукополиcахариды и коллагеновый белок. Проницаемость клубочкового фильтра в сущности зависит от состояния базальной мембраны, так как ее отверстия являются наименьшими, порядка 5 нанометров (по Руйе).
Фильтрующая мембрана клубочка способна пропускать почти все имеющиеся в плазме вещества с молекулярной массой ниже 70 000, а также небольшую часть альбуминов. В определенных условиях через почечный фильтр проходят и более крупные молекулы белков, например антигены брюшнотифозной и дизентерийной палочек, вирус гриппа, кори и др.
Фильтрация в клубочках определяется фильтрационным давлением (ФД). Нормальное ФД = 75-(25+10) = 40 мм рт. ст., где 75 мм рт. ст. — гидростатическое давление в капиллярах клубочков; 25 мм рт. ст. — онкотическое давление белков плазмы; 10 мм рт. ст. — внутрипочечное давление. Фильтрационное давление может варьировать в пределах 25-50 мм рт. ст. Фильтрации подвергается примерно 20% плазмы крови, протекающей по капиллярам клубочков (фильтрационная фракция).
§ 304. Показатель очищения (клиренс)
Для выявления фильтрационной способности почек пользуются определением показателя очищения. Показателем очищения, или клиренсом (от англ. clear — очищать), называется объем плазмы крови, который полностью освобождается почками от данного вещества за 1 мин. Клиренс определяют по выведению циркулирующих в крови эндогенных веществ (например, эндогенному креатинину) или по выведению специально вводимых в кровь веществ (например, инулину и др.). Для вычисления клиренса надо знать содержание вещества в крови (К), содержание его в моче (М) и минутный диурез (Д) — количество мочи, выделившейся за 1 мин. Клиренс (С) вычисляют по формуле:
Показатель очищения неодинаков для различных веществ. Например, средняя величина клиренса инулина (полисахарид) составляет 120 мл/мин, мочевины — 70 мл/мин, фенол рота — 400 мл/мин и т. д. Эта разница объясняется тем, что инулин выводится путем фильтрации и обратно не реабсорбируется; мочевина фильтруется, но частично ре-абсорбируется, а фенолрот выделяется путем активной секреции в канальцах и частично фильтруется.
Для определения подлинной фильтрационной способности клубочков, т. е. количества образующейся за 1 минуту первичной мочи, необходимо применять вещества, которые выделяются только путем фильтрации и не подвергаются реабсорбции в канальцах. К ним относятся беспороговые вещества, например инулин и гипосульфит. У взрослого человека величина клубочковой фильтрации (объем первичной мочи) составляет в среднем 120 мл/мин, т. е. 150-170 л/сут. Падение этого показателя свидетельствует о нарушении фильтрационной функции почек.
§ 305. Эффективность почечного кровотока
Показатель очищения парааминогиппуровой кислоты (ПАГ) дает возможность определить эффективность почечного кровотока. Это вещество попадает в мочу путем активной секреции и оттекающая от почки кровь не содержит ПАГ. Поэтому показатель очищения ПАГ соответствует объему плазмы крови, прошедшей за 1 мин через сосуды почек. Он равен в среднем 650 мл/мин. Величину объема крови, а не плазмы, прошедшей через почки, можно определить, сделав поправку по гематокриту (в норме объем эритроцитов равен 45%, плазмы — 55%). Составив пропорцию, вычисляют почечный кровоток: 660 мл — 55%, X-100%, X = 1200 мл/мин.
Следует учитывать, что клиренс ПАГ не всегда адекватен почечному кровотоку. Коэффициент очищения ПАГ может падать при неизмененном почечном кровотоке, если нарушаются процессы секреции вследствие значительного повреждения канальцев (хронический нефрит, нефроз и пр.).
Стойкое снижение эффективности почечного кровотока встречается при гипертонической болезни, а также является ранним признаком развивающегося артериосклероза почек.
§ 306. Нарушение клубочковой фильтрации
Снижение фильтрации. Уменьшение образования первичной мочи зависит от ряда внепочечных и почечных факторов. К ним относятся:
- падение артериального давления [показать]
- сужение почечной артерии и артериол [показать]
- повышение онкотического давления крови [показать]
- нарушение оттока мочи [показать]
- уменьшение количества функционирующих клубочков [показать]
- повреждение фильтрующей мембраны [показать]
Прогрессирующее уменьшение количества функционирующих нефронов типично для хронически протекающих почечных заболеваний с диффузным поражением почек. Сюда относятся хронический гломерулонефрит, артериосклероз почек, пиелонефрит и др. Эти заболевания сопровождаются склерозированием клубочков и гибелью нефронов, заканчиваются сморщиванием почки. При сокращении количества действующих нефронов до 1/10-1/20 их нормальной величины, фильтрация прекращается, развивается тяжелая уремия (см. § 314).
Увеличение клубочковой фильтрации наблюдается при:
- повышении тонуса отводящей артериолы. Спазм выносящей артериолы и увеличение фильтрации отмечаются при введении малых доз адреналина (адреналовая полиурия), в начальной стадии гипертонической болезни.
- уменьшении тонуса приводящей артериолы. Тонус приводящей артериолы может уменьшиться рефлекторно вследствие ограничения циркуляции крови на периферии тела, например при лихорадке (увеличение диуреза в стадию подъема температуры).
- понижении онкотического давления крови. Усиление фильтрации, обусловленное падением онкотического давления, отмечается при обильном введении жидкости или вследствие разжижения крови (во время спадения отеков).
§ 307. Нарушение канальцевой реабсорбции
Эпителиальные клетки различных отделов канальцев обладают высокоспециализированными функциями. Они содержат разнообразные ферменты и молекулы-переносчики, участвующие в транспорте веществ из канальцев в кровь (реабсорбция) и из крови в просвет канальцев (секреция). Эти процессы протекают активно против высокого концентрационного градиента и с большим расходованием энергии клеточного дыхания.
К наиболее общим механизмам нарушения канальцевой реабсорбции относятся:
- перенапряжение процессов реабсорбции и истощение ферментных систем вследствие избытка реабсорбируемых веществ в первичной моче;
- падение активности ферментов канальцевого аппарата: а) наследственный дефект ферментов, обеспечивающих реабсорбцию отдельных веществ или б) блокада ферментов ингибиторами;
- структурные повреждения канальцев (дистрофия, некроз) при инфекционно-воспалительных процессах, расстройствах кровоснабжения почек, особенно кортикального кровотока, и отравлениях ядами.
- Нарушение реабсорбции глюкозы [показать]
- Нарушение реабсорбции белка [показать]
- Нарушение реабсорбции аминокислот [показать]
- Нарушение реабсорбции натрия [показать]
- Нарушение реабсорбции воды [показать]
§ 308. Нарушение способности почек к концентрированию и разведению мочи
Почки человека в состоянии выделить мочу в 4 раза гипертоничнее и в 6 раз гипотоничнее плазмы. В нормальных условиях концентрация веществ в окончательной моче во много раз превышает их концентрацию в плазме (табл. 31).
О концентрационной способности почек можно судить по относительной плотности (удельному весу) мочи. Но не всегда эти показатели совпадают.
У здорового человека относительная плотность мочи при обычной диете не ниже 1,016-1,020 и колеблется в зависимости от приема воды и водно-солевого баланса в пределах 1,002-1,035 и более. С возрастом осмотическая концентрация и относительная плотность мочи снижаются.
Неспособность почек концентрировать мочу называется гипостенурией. Относительная плотность мочи падает до 1,012-1,006 и в течение суток колеблется незначительно (рис. 77). Гипостенурия в сочетании с полиурией свидетельствует о повреждении канальцевого аппарата почек при относительно достаточной функции клубочков (ранняя стадия хронического нефрита, пиелонефрит). Гипостенурия в сочетании с олигурией указывает на вовлечение в патологический процесс все большего числа клубочков, в результате чего образуется мало первичной мочи.
Более опасным признаком повреждения почек является изостенурия, когда относительная плотность мочи приближается к относительной плотности клубочкового фильтрата (1,010) и не меняется (монотонный диурез). Изостенурия свидетельствует о нарушении канальцевой реабсорбции воды и солей, о потере способности почек к концентрированию и разведению мочи. В результате деструкции эпителиальных клеток канальцы превращаются в простые трубки, проводящие клубочковый фильтрат в почечные лоханки. Сочетание изостенурии с олигурией является показателем тяжелой недостаточности функции почек.
§ 309. Нарушение канальцевой секреции
При заболеваниях почек могут нарушаться процессы секреции в канальцах, и все вещества, выделяемые путем секреции, например антибиотики, йодсодержащие контрастные препараты, накапливаются в крови.
Задержка в крови пенициллина и продуктов его превращений может оказать токсическое действие на организм. Поэтому при заболеваниях почек пенициллин, как и некоторые другие антибиотики, следует применять с осторожностью.
Нарушение секреции мочевой кислоты встречается как наследственный дефект. Накопление в крови мочевой кислоты и мочекислых солей приводит к развитию так называемой почечной подагры.
Усиленная секреция калия отмечается при избытке гормона альдостерона и при употреблении мочегонных средств — ингибиторов фермента карбоангидразы. Потеря калия (калиевый диабет) приводит к гипокалиемии и тяжелым расстройствам функций.
Почки выполняют весьма ценную физиологическую функцию по поддержанию постоянства pH крови. Эта функция связана большей частью с процессами ацидогенеза и аммониогенеза.
| Ацидогенез — образование в канальцевых клетках свободных Н + -ионов и секреция их в просвет канальцев. Реакция идет при участии фермента карбоангидразы (СО 2 + Н 2 О карбоангидраза -> Н 2 СO 3 -> Н + + НСО — 3 .
Аммониогенез — образование аммиака и аммония. Источником аммиака являются аминокислоты, в основном глютамин. Далее образуется ион аммония: NH 3 + H + ->NH 4 . Секреция Н + — ионов создает условия для реабсорбции натрия и бикарбоната и для выведения из организма кислых продуктов в виде титруемых кислот. Ионы водорода вытесняют натрий из соединений с анионами слабых органических кислот и из фосфатного буфера. Ионы аммония вытесняют натрий из соединений с сильными кислотами. Натрий всасывается в виде бикарбоната и щелочной резерв крови сохраняется, а выделяемая моча имеет кислую реакцию (pH мочи в норме равняется 5,5-6,5, но может варьировать в зависимости от характера пищи от 4,5 до 7,8). |
При нарушениях процесса ацидо- и аммониогенеза теряется большое количество натрия и бикарбонатов. В моче преобладают щелочные фосфаты (Na 2 НРO 4) вместо кислых (NaH 2 PO 4) и реакция ее становится щелочной. При потере половинного количества бикарбонатов крови развивается метаболический ацидоз.
Причинами нарушения ацидогенеза и аммониогенеза являются:
- длительные почечные заболевания с выраженными повреждениями или атрофией канальцев;
- наследственный дефект синтеза ферментных систем, обеспечивающих активную секрецию водородных ионов (почечный канальцевый ацидоз);
- прием некоторых мочегонных препаратов — ингибиторов фермента карбоангидразы, например диакарба (назначается под контролем врача).
§ 310. Патологические составные части мочи при заболеваниях почек
К патологическим составным частям мочи относятся элементы, не встречающиеся в моче здоровых людей, а также вещества, количество которых превышает норму. Однако не всякое изменение состава мочи свидетельствует о повреждении почек. Например, билирубин в моче появляется при печеночной желтухе, ацетон и сахар — при диабете.
Для заболеваний почек наиболее характерны следующие симптомы:
- Гематурия — появление в моче эритроцитов. В норме эритроциты не проходят через фильтрующую мембрану. При грубом ее повреждении (острый гломерулонефрит) эритроциты проникают в капсулу Боумена-Шумлянского и выделяются с мочой, которая приобретает красноватый оттенок. Эритроциты могут попасть в мочу из мочеточников (ранение проходящим камнем) или из мочевого пузыря (опухоль, воспаление).
- Протеинурия — выделение белка с мочой. Почечная протеинурия возникает или вследствие повреждения клубочков, когда повышается их проницаемость для белка, или вследствие нарушения реабсорбции белка в канальцах (см. § 307).
- Лейкоцитурия — присутствие в моче лейкоцитов (в норме в осадке мочи их обнаруживается не более 1-3 в поле зрения). Лейкоцитурия характерна для воспалительных процессов в почках (пиелонефрит) и в мочевыводящих путях. Пиурия — выделение мутной мочи с примесью гноя и лейкоцитов.
- Цилиндрурия — появление в моче различного рода цилиндров. Например, гиалиновые цилиндры возникают в результате свертывания белка в просвете канальцев при воспалительных и дистрофических процессах. Эпителиальные и зернистые цилиндры состоят из перерожденных эпителиальных клеток канальцев.
- Осадки солей в виде уратов, оксалатов и фосфатов появляются при почечнокаменной болезни.
§ 311. Почечнокаменная болезнь
Почечнокаменная болезнь является следствием нарушенного выделения солей почками. Причина этого заболевания изучена недостаточно. Камнеобразованию в почках способствует ряд факторов: нарушение минерального обмена, инфицирование мочевых путей, застой мочи, травмы почек, недостаток в пище витаминов А и D, наследственный дефект обмена веществ (оксалоз).
Камни состоят из фосфатов (кальциевые соли фосфорной кислоты), оксалатов (кальциевые соли щавелевой кислоты), уратов (соли мочевой кислоты) и могут иметь смешанный состав. Встречаются цистиновые камни при наследственном заболевании (цистинурия), сульфаниламидные камни при повышенной концентрации в моче сульфаниламидных препаратов, ксантиновые камни.
По кристаллизационной теории, камни образуются вследствие перенасыщения мочи кристаллоидами и выпадения их в осадок.
Согласно теории матрицы, соли наслаиваются вокруг каркаса, состоящего из белка и углеводов (нерастворимый мукополисахаридный комплекс). В его формировании участвуют белки плазмы, интенсивно проникающие в капсулу при повышенной проницаемости клубочков, а также уромукоид, выделяемый эпителием канальцев вследствие их раздражения. Органическая матрица первично образуется в канальцах не менее чем в 95% камней. Рост камня происходит путем отложения на нем чередующихся концентрических слоев мукополисахаридов и кристаллоидов.
Почечные камни и осадки в моче имеют разнообразную форму и различаются по величине. Они обнаруживаются в виде мелких песчинок или больших образований, заполняющих полость лоханки.
Продолжение : Глава 3. Недостаточность функции почек
bono-esse.ru
Строение нефрона
Моча представляет собой концентрат веществ, выведение которых из организма необходимо для поддержания постоянства внутренней среды. Это своего рода «отходы» жизнедеятельности, в том числе и токсичные, дальнейшее преобразование которых невозможно, а накопление вредно. Функцию выведения этих веществ выполняет мочевыделительная система, основной частью которой являются почки – биологические фильтры. Через них проходит кровь, освобождаясь от излишков жидкости и токсинов.
На рис. 1 схематично изображено строение нефрона. А – почечное тельце: 1– приносящая артерия; 2– выносящая артерия; 3 – эпителиальные листки капсулы (внешний и внутренний); 4 – начало канальца нефрона; 5 – сосудистый клубочек. Б – собственно нефрон: 1 – капсула клубочка; 2 – каналец нефрона; 3 – собирательный каналец. Кровеносные сосуды нефрона: а – приносящая артерия; б – выносящая артерия; в – канальцевые капилляры; г – вена нефрона.
При различных патологических процессах происходит обратимое или необратимое повреждение нефронов, вследствие чего некоторая часть из них может перестать выполнять свои функции. В результате происходит изменение выработки мочи (задержка токсинов и воды, потеря полезных веществ через почки и другие синдромы).
Понятие о клубочковой фильтрации
Процесс образования мочи состоит из нескольких этапов. На каждом из этапов может произойти сбой, приводящий к нарушению функции всего органа. Первый этап образования мочи называется клубочковой фильтрацией.
Ее осуществляет почечное тельце. Оно состоит из сети мелких артерий, сформированных в виде клубочка, окруженного двуслойной капсулой. Внутренний листок капсулы плотно прилегает к стенкам артерий, образуя почечную мембрану (гломерулярный фильтр, от лат. glomerulus – клубочек).
Он состоит из следующих элементов:
- эндотелиальные клетки (внутренняя «выстилка» артерий);
- эпителиальные клетки-капсулы, образующие внутренний ее листок;
- прослойка из соединительной ткани (базальная мембрана).
Именно через почечную мембрану происходит выделения воды и различных веществ, и от ее состояния зависит, насколько полноценно почки выполняют свою функцию.
Крупные (белковые) молекулы и клеточные элементы крови через почечную мембрану не проходят. При некоторых заболеваниях они все же могут через нее проходить из-за повышенной ее проницаемости и попадать в мочу.
Раствор ионов и мелких молекул в отфильтрованной жидкости носит название первичной мочи. Содержание веществ в ее составе очень низкое. Она сходна с плазмой, из которой удален белок. В почках фильтруется от 150 до 190 литров первичной мочи за одни сутки. В процессе дальнейшего преобразования, которое первичная моча претерпевает в канальцах нефрона, ее окончательный объем уменьшается примерно в 100 раз, до 1,5 литров (вторичная моча).
Канальцевая секреция и реабсорбция – процессы образования вторичной мочи
Из-за того что в первичную мочу во время пассивной канальцевой фильтрации попадает большое количество воды и нужных организму веществ, выведение ее из организма в неизменном виде было бы биологически нецелесообразно. Кроме того, некоторые токсические вещества образуются в довольно больших количествах, и их выведение должно быть более интенсивным. Поэтому первичная моча, проходя по системе канальцев, подвергается преобразованию посредством секреции и реабсорбции.
На рис. 2 изображены схемы канальцевой реабсорбции и секреции.
Канальцевая реабсорбция (1). Это процесс, в результате которого вода, а также нужные вещества посредством работы ферментных систем, механизмов обмена ионов и эндоцитоза, «забирается» из первичной мочи и возвращается в кровеносное русло. Это возможно благодаря тому, что канальцы нефрона густо оплетены капиллярами.
Канальцевая секреция (2) – процесс, обратный реабсорбции. Это выведение различных веществ с использованием специальных механизмов. Эпителиальные клетки активно, вопреки осмотическому градиенту, «изымают» некоторые вещества из сосудистого русла и секретируют их в просвет канальцев.
В результате этих процессов в моче происходит увеличение концентрации вредных веществ, выведение которых необходимо, по сравнению с их концентрацией в плазме (например, аммиак, метаболиты лекарственных веществ). А также предотвращается потеря воды и полезных веществ (например, глюкозы).
Некоторые вещества являются индифферентными по отношению к процессам секреции и реабсорбции, их содержание в моче пропорционально таковому в крови (один из примеров – инсулин). Соотнесение концентрации подобного вещества в моче и крови позволяет сделать вывод о том, насколько хорошо или плохо происходит клубочковая фильтрация.
Скорость клубочковой фильтрации: клиническое значение, принцип определения
Скорость клубочковой фильтрации (СКФ) – показатель, являющийся основным количественным отражением процесса образования первичной мочи. Для того чтобы понять, какие изменения отражают колебания этого показателя, важно знать, от чего зависит СКФ.
Она находится под влиянием следующих факторов:
- Объем крови, проходящий через сосуды почек в некоторый временной промежуток.
- Фильтрационное давление – разница между давлением в артериях почки и давлением отфильтрованной первичной мочи в капсуле и канальцах нефрона.
- Фильтрационная поверхность – совокупная площадь капилляров, которые участвуют в фильтрации.
- Количество функционирующих нефронов.
Первые 3 фактора являются относительно изменчивыми и регулируются посредством местных и общих нейрогуморальных механизмов. Последний фактор – количество функционирующих нефронов – является довольно постоянным, и именно он наиболее сильно влияет на изменение (снижение) скорости клубочковой фильтрации. Поэтому в клинической практике СКФ чаще всего исследуется для определения стадии хронической почечной недостаточности (она развивается именно из-за потери нефронов вследствие различных патологических процессов).
О водовыделительной функции почек судят по количеству выделенной мочи, чаще всего за сутки. Концентрационную способность определяют при помощи исследования удельного веса мочи. Определение удельного веса мочи производят специальным прибором - урометром (см.). Уже само по себе резкое уменьшение выделения почками мочи, т. е. олигурия или анурия (см.), а также значительное повышение суточного выделения мочи, т. е, полиурия (см.), говорят о нарушении функций почек. Водная проба (проба на разведение), при которой больному дают выпить натощак 1,5 л воды (по Фольгарду), а потом измеряют в течение 4 часов через каждые полчаса диурез, преимущественно зависит от внепочечных факторов, а поэтому ее значение при оценке функции почек ограничено.
Большее практическое значение имеет исследование концентрационной способности почек, особенно проба с сухоядением. Эта проба и ее варианты (пробы Фольгарда, Фишберга и др.) основаны на том, что больной в течение определенного времени получает только сухую пищу, содержащую большие количества животного белка (в виде творога, мяса или яиц). При этом собираются отдельные порции мочи (с 8 часов утра до 8 часов вечера или три утренние часовые порции), в которых определяют количество выделенной мочи и ее удельный вес.
В результате проб с сухоядением у лиц с нормальной концентрационной функцией почек количество мочи в отдельных порциях резко падает до 30-60 мл; за сутки выделяется 300-500 мл. Удельный вес мочи в то же время нарастает и достигает в отдельных порциях 1,027-1,032.
При нарушении концентрационной функции почек количество суточной мочи и величина отдельных порций становятся значительно больше, чем в норме. Удельный вес ни в одной порции не достигает 1,025, а часто и не превышает 1,016-1,018 (так называемая гипостенурия). При более выраженных нарушениях концентрационной функции почек сухоядение может вовсе не оказывать влияния на характер мочеотделения, а удельный вес мочи - оставаться постоянно низким (в пределах 1,008-1,014). Состояние, при котором выделяется моча фиксированного низкого удельного веса, называется изостенурией. Удельный вес мочи при этом равен удельному весу безбелкового фильтрата плазмы. Гипо- и особенно изостенурия являются показателями глубоких изменений эпителия почечных канальцев и обнаруживаются, как правило, при сморщенных почках.
Однако снижение концентрационной способности почек может зависеть и от внепочечных влияний (например, при понижении функции гипофиза в отношении выделения антидиуретического гормона). Пробу с сухоядением не следует проводить при указаниях на нарушение азотовыделительной функции почек. Неправильный результат пробы может иметь место, если ее проводить у больных с отеками, так как сухоядение способствует схождению отеков и низкий удельный вес мочи в этом случае может зависеть не от почечной недостаточности, а от усиленного диуреза.
Широкое распространение в силу простоты получила проба Зимницкого (1924). Эта проба проводится без всяких нагрузок, в обычных условиях жизни и питания больного и может применяться при нарушении азотовыделительной функции почек. В течение суток собирают 8 порций мочи (через каждые 3 часа). В этих порциях определяют количество и удельный вес мочи, отдельно вычисляется дневной и ночной диурез. В норме обнаруживаются значительные колебания как количества, так и удельного веса мочи в отдельных порциях. В общей сложности здоровый человек выделяет с мочой 75% выпитой жидкости, большая часть выводится в течение дня, меньшая - ночью. При пробе Зимницкого могут обнаруживаться нарушения концентрационной функции почек, но менее надежно, чем при пробе с сухоядением, так как последняя дает возможность выявить максимальную концентрационную способность почек. Удельный вес мочи при пробе Зимницкого в пределах 1,025-1,026 делает излишней последующую пробу с сухоядением.
Исследование содержания остаточного азота и его фракций в крови является одним из важнейших методов исследования функции почек. Остаточным азотом называют то количество азота в крови, которое определяется в ней после осаждения белков. Остаточный азот (RN) в норме равняется 20- 40 мг% и состоит из азота мочевины (большая часть, приблизительно 70%), азота креатинина, креатина, мочевой кислоты, аминокислот, аммиака, индикана и т. д. Количество мочевины в плазме крови равняется в норме 20-40 мг% (причем, в молекуле мочевины азот составляет 50%). Содержание креатинина в крови в норме составляет 1-2 мг%, индикана - от 0,02 до 0,2 мг%.
Данные, получаемые при исследовании остаточного азота и его фракций в крови, не могут претендовать на выявление ранних или тонких нарушений функций почек, однако имеют существенное значение для клиники при суждении о выраженности, т. е. степени почечной недостаточности. Уже небольшое повышение остаточного азота в крови (до 50 мг%) может говорить о нарушении азотовыделительной функции почек. При резком нарушении функции почек и развитии азотемической уремии содержание остаточного азота и мочевины в крови может достигать 500-1000 мг%, креатинина 35 мг%. Азотемия при хронических заболеваниях почек развивается сравнительно медленно, но при острых олигоанурических поражениях почек нарастание азотемии может идти крайне бурно и достигать максимальных известных в патологии величин. Азотемия одной и той же степени неравнозначна прогностически при острой и хронической уремии. Прогноз при хронической уремии значительно тяжелее.
Для почек характерно многообразие функций, как экскреторных (дезинтоксикационная, поддержание водного, электролитного баланса, кислотно-основного равновесия), так и инкреторных (участие в ренин-ангиотензиновой, кинин-калликреиновой системах, выработке эритропоэтина, простагландинов, витамина Д3).
Нарушения образования и выделения мочи может выражаться в виде изменения количества мочи, ее относительной плотности и состава, суточного диуреза, что может быть проявлением заболевания почек, а также заболеваний внепочечной локализации (сахарный диабет, острая и хроническая сердечная недостаточность и др.)
Полиурия (polys - много, uron - моча) характеризуется увеличением объема суточного диуреза свыше 2000 мл. В механизме развития полиурии играют роль увеличение клубочковой фильтрации плазмы крови и (или) уменьшение реабсорбции воды в канальцах.
Олигурия (olygos - малый) характеризуется снижением суточного диуреза до 500-300 мл. Причинами этого могут являться снижение клубочковой фильтрации, усиление реабсорбции воды в канальцах почек или затруднение оттока мочи.
Анурия (an - отсутствие) характеризуется прекращением мочеотделения или выделением мочи в количестве менее 300 мл/ сутки.
Превалирование ночного диуреза над дневным - никтурия (от nictos - ночь), тогда как у здорового человека объем дневного диуреза составляет 65-80% от общего объема суточной мочи.
Частота мочеиспускания может увеличиваться (поллакиурия, от греч. pollakis - часто) или снижаться (оллакизурия, от греч. ollakis - редко).
Концентрационная функция - способность почек концентрировать и разводить мочу. Эти процессы зависят от эффективной работы нефронов, общей гемодинамики, уровня артериального давления, почечного кровотока, нейрогуморальной регуляции и др. факторов. Показателем концентрационной способности почек является относительная плотность мочи. У здорового человека она колеблется от 1010 до 1025. В условиях патологии относительная плотность мочи может изменяться: гиперстенурия (hyper - много, sthenos - сила) характеризуется увеличением относительной плотности мочи более 1030 вследствие усиления процесса реабсорбции воды в дистальном отделе нефрона (при сухоядении, больших внепочечных потерях внеклеточной жидкости); гипостенурия (hypo - мало) означает снижение относительной плотности мочи; при пробе с сухоядением относительная плотность мочи не достигает 1026; изостенурия (isos - равный) - относительная плотность мочи очень мало колеблется в течение суток и близка к осмотическому давлению плазмы крови. В условиях патологии почек относительная плотность мочи может изменяться независимо от поступления в организм жидкости.
Изменения состава мочи характеризуются появлением в ней белка (протеинурия), глюкозы (глюкозурия), аминокислот (аминоацидурия), крови (гематурия), лейкоцитов (лейкоцитурия), цилиндров (цилиндрурия), клеток эпителия почечных канальцев или мочевыводящих путей, кристаллов различных солей или аминокислот (кристаллурия), микроорганизмов (бактериурия).
Протеинурия.
У здорового человека в клубочках из плазмы крови фильтруется 0,5 г белка/сутки. Значительная часть поступившего в клубочковый фильтрат белка реабсорбируется в проксимальных канальцах посредством пиноцитоза. Выделение с мочой более 150 мг белка/сутки называется протеинурией. В норме проникновению белков плазмы крови в клубочковый фильтрат препятствуют гломерулярный фильтр (базальная мембрана, подоциты). Базальная мембрана обладает избирательной проницаемостью относительно размера молекулы и электрического заряда. Отрицательный заряд клубочкового фильтра обусловлен присутствием в нем сиалогликопротеина и гликозаминогликанов. Следовательно, отрицательно заряженные молекулы, в том числе молекулы альбумина не могут пройти через базальную мембрану. Молекулы белка до 1,4 нм свободно проходят через гломерулярный фильтр, от 2 до 4 нм проход затруднен, белки свыше 4 нм через гломерулярный фильтр не проходят.
По механизму развития различают клубочковую и канальцевую протеинурию. Первая связана с повышенной проницаемостью клубочкового фильтра, вторая - с нарушением реабсорбции белка в проксимальном канальце вследствие недостаточности функции эпителия.
Клубочковая протеинурия подразделяется на селективную и неселективную протеинурию. Развитие селективной протеинурии связано с утратой отрицательного заряда базальной мембраны и способности отталкивать отрицательно заряженные молекулы белка. Отрицательно заряженные белки альбумин и трансферрин начинают свободно проходить через незаряженный фильтр и развивается массивная протеинурия. Она наблюдается при нефротическом синдроме с минимальными изменениями.
Неселективная протеинурия возникает при утрате гломерулярным фильтром способности регулировать прохождение молекул белка в зависимости от их размера. В связи с этим в ультрафильтрат поступают крупнодисперсные белки плазмы, например иммуноглобулины G 1 , а 2 -макроглобулин и в-липопротеины.
Гематурия (от греч. haima - кровь) - присутствие крови в моче. Различают микро- и макрогематурию. Микрогематурия не изменяет цвета мочи, ее можно выявить только при микроскопии осадка или с помощью индикаторной полоски. Макрогематурия придает моче цвет мясных помоев. Причины развития гематурии разнообразны: 1) заболевания почек - гломерулонефрит, тубулоинтерстициальный нефрит, поликистоз, поражение почек при системной красной волчанке, пурпуре Шенлейна-Геноха, туберкулезе и др.; 2) повреждения мочевыводящих путей при почечно-каменной болезни, уролитиазе, травмах, развитии опухолей и др. Гематурия иногда обнаруживается при больших физических нагрузках.
Цилиндрурия - присутствие в осадке мочи плотных масс, подобных слепкам почечных канальцев, в которых они формируются. В зависимости от состава различают цилиндры гиалиновые, зернистые, эпителиальные, жировые, восковидные, гемоглобиновые, эритроцитарные и лейкоцитарные. Матрицей цилиндров являются белки. Гиалиновые цилиндры могут обнаруживаться в моче здоровых людей, состоят из белка Тамма-Хорсфалля, образующегося в мочевом тракте. В состав других цилиндров входят белки почечного или плазменного происхождения. Присутствие цилиндров, как правило, свидетельствует о заболевании почек (гломерулонефриты, острый некроз почек, амилоидоз, пиелонефрит и др.).
Лейкоцитурия - присутствие в моче лейкоцитов в количестве более 5 в поле зрения микроскопа. Выявляется при остром и хроническом пиелонефрите и воспалительных процессах в мочевыводящих путях.
К изменениям состава мочи, не связанным с заболеваниями почек, относятся билирубинурия, гемоглобинурия, кетонурия; глюкозурия и аминоацидурия наблюдаются как при заболеваниях почек (тубулопатиях), так и при заболеваниях других органов (сахарный диабет, заболевания печени).
Оценка функциональной способности почек.
1). Скорость клубочковой фильтраци рассчитывается по клиренсу веществ, которые полностью фильтруется, практически не секретируется и не реабсорбируется канальцами. В этих целях можно использовать вещества, специально вводимые в кровь (например, инулин), либо определять клиренс по выведению циркулирующих в крови эндогенных веществ (креатинина). Более физиологическим является определение клиренса эндогенного креатинин (проба Реберга).
Скорость клубочковой фильтрации определяется по формуле:
СКФ (мл/мин) = креатинин мочи х минутный объем мочи
креатинин крови
Величина клубочковой фильтрации, в норме у здоровых людей колеблется от 80 до 120 мл/мин.
2) Канальцевая реабсорбция (разница между объемом первичной мочи и минутным диурезом) вычисляется по формуле:
КР = (СКФ - диурез) x 100 %
В норме колеблется от 95 до 99 %.
3). Концентрационная функция
Можно определить по соотношению концентрации креатинина в моче и крови (U/P) -- в норме более 60.
Концентрационную функцию определяют, используя пробу Зимницкого. Пациент находится в обычных условиях, принимает обычную пищу, но учитывается количество выпиваемой за сутки жидкости, которое не должно превышать 1 - 1,5 л. Пациент собирает 8 порций мочи каждые три часа, в течение суток. Определяют объем и относительную плотность мочи в каждой порции.
Нормальные значения пробы Зимницкого
Для нормальной функции почек характерно:
- - суточный диурез около 1,5 л;
- - выделение с мочой 50 - 80% всей выпитой за сутки жидкости;
- - значительное преобладание дневного диуреза (около 2/3 от суточного) над ночным (1/3 суточного диуреза);
- - удельный вес хотя бы в одной из порций не ниже 1020 - 1022;
- - значительные колебания в течение суток количества мочи в отдельных порциях (от 50 до 400 мл) и удельного веса мочи (от 1003 до 1028).
Клиническое значение пробы Зимницкого
Если дневной диурез становится равным ночному или ночной диурез преобладает, это может говорить либо о недостаточности кровообращения, либо об ограничении концентрационной способности почек. Наибольшее значение при суждении о нарушении концентрационной функции почек по пробе Зимницкого имеет монотонный характер отдельных порций мочи в отношении как одинакового количества выделяемой мочи, так и ее удельного веса.
4). Канальцевая секреция определяется по величине почечного плазмотока. Для количественной оценки почечного плазмотока (объема плазмы, протекающей через почку в единицу времени) определяется клиренс вещества, от которого плазма полностью освобождается при однократном прохождении через почечную паренхиму. Чаще вычисляется по клиренсу парааминогиппуровой кислоты (ПАГ) или диодраста.
Величину эффективного почечного плазмотока (ПП) вычисляют по формуле:
ПП =U ПАГ x V (мл/ мин)
где U ПАГ -- концентрация ПАГ в моче;
Р ПАГ - концентрация ПАГ в плазме;
V -- диурез, мл/мин.
В норме величина клиренса ПАГ, т.е. эффективного почечного плазмотока, равняется 550--650 мл/мин.
Для измерения величины эффективного почечного кровотока (ПК) необходимо одновременно вычислять показатель гематокрита (Ht), тогда используется следующая формула: ПК=ПП/(1-Нt)